Patógenos y cambio planetario
Podcast
Resumen
En este texto, se ofrece un resumen detallado del artículo de revisión "Patógenos y cambio planetario" publicado en Nature Reviews Biodiversity. El artículo analiza la relación multifacética entre la pérdida de biodiversidad y la aparición de enfermedades infecciosas, sus impulsores antropogénicos comunes y sus consecuencias para los futuros riesgos de epidemias y pandemias.
Puntos Clave:
- Las actividades humanas han creado una policrisis planetaria que incluye pandemias, cambio climático y la sexta extinción masiva.
- La pérdida de biodiversidad y la aparición de enfermedades infecciosas están interconectadas y comparten impulsores antropogénicos comunes, como el cambio de uso de la tierra, la agricultura, el cambio climático y la utilización de la vida silvestre.
- La ciencia de la biodiversidad se puede aprovechar para desarrollar una mejor infraestructura de vigilancia y estrategias basadas en ecosistemas para la prevención de brotes.
- Se necesitan soluciones integradas que aborden los impulsores planetarios de la pérdida de biodiversidad y la aparición de enfermedades, incluyendo la gobernanza planetaria y la inversión en salud pública.
Biodiversidad y Enfermedades Infecciosas:
- Los parásitos y patógenos representan una fracción sustancial de la biodiversidad global.
- Existe una fuerte correlación positiva entre la riqueza de especies hospedadoras y la riqueza de especies de parásitos: la diversidad engendra diversidad.
- La pérdida de biodiversidad no favorece a todos los patógenos por igual. Algunos disminuyen o se pierden junto con sus hospedadores, mientras que otros se vuelven más prevalentes a medida que sus hospedadores o vectores se vuelven más abundantes.
- La fragmentación del bosque favorece a especies como el ratón de patas blancas (Peromyscus leucopus), un hospedador altamente competente para la bacteria que causa la enfermedad de Lyme y las garrapatas que la transmiten.
- La pérdida de anfibios que se alimentan de larvas de mosquitos puede haber aumentado la incidencia de malaria en Costa Rica y Panamá.
- La pérdida de murciélagos insectívoros puede haber obligado a los agricultores a usar más insecticidas, lo que lleva a tasas más altas de mortalidad infantil en el este de los EE. UU.
Impulsores Comunes y Vías Causales:
- El cambio de uso de la tierra es el mayor impulsor de la deforestación y a menudo se cita como el principal impulsor del desbordamiento zoonótico.
- La agricultura animal presenta riesgos únicos, ya que el ganado a menudo actúa como hospedador puente o amplificador en el proceso de aparición de enfermedades.
- El cambio climático agrava los riesgos de enfermedades al alterar los rangos geográficos de los patógenos y vectores, influir en la dinámica de transmisión y afectar el comportamiento del hospedador.
- La utilización de la vida silvestre, incluyendo la caza de animales silvestres, el comercio y el contacto con la vida silvestre, aumenta las oportunidades de desbordamiento zoonótico.
Ejemplos de Estudio de Caso:
El artículo presenta cuatro estudios de caso para ejemplificar cómo la variación en el modo de transmisión de patógenos, la identidad del hospedador o vector de vida silvestre y el contexto antropogénico pueden influir en la dinámica de la aparición de enfermedades.
- Enfermedad de Lyme: La fragmentación del bosque ha favorecido a los hospedadores competentes, como ratones y ardillas listadas, mientras que la pérdida de depredadores clave, como los zorros rojos, también ha contribuido al aumento de la incidencia.
- Virus Hendra: La pérdida de hábitat ha llevado a los zorros voladores australianos a asentarse en entornos urbanos, aumentando el contacto humano-murciélago y el riesgo de desbordamiento.
- Influenza: La intensificación de la agricultura y el cambio climático han creado condiciones ideales para la propagación del virus de la influenza en aves de corral y la aparición de nuevas cepas.
- Coronavirus: El comercio de vida silvestre es un importante impulsor del desbordamiento de coronavirus, como el SARS-CoV y el SARS-CoV-2.
Soluciones Compartidas para la Biodiversidad y la Salud:
- Vigilancia basada en la biodiversidad: Los datos de biodiversidad se pueden utilizar para monitorear los patógenos, identificar áreas de alto riesgo y predecir eventos de desbordamiento.
- Estrategias basadas en ecosistemas: La restauración y conservación de ecosistemas pueden reducir el riesgo de desbordamiento zoonótico al mantener la diversidad de hospedadores, promover la salud del ecosistema y minimizar el contacto humano-vida silvestre.
- Inversión en salud pública: Fortalecer los sistemas de salud, mejorar la vigilancia de enfermedades y desarrollar contramedidas médicas es fundamental para prevenir y controlar los brotes.
- Gobernanza planetaria: Se necesitan mecanismos de gobernanza global para abordar los impulsores de la pérdida de biodiversidad y la aparición de enfermedades, promover la colaboración internacional y garantizar la financiación sostenible para la prevención de pandemias.
Problemas Sin Resolver para la Gobernanza Planetaria:
- La falta de coordinación entre los esfuerzos globales sobre la pérdida de biodiversidad y las enfermedades infecciosas ha obstaculizado el progreso en la prevención de pandemias.
- El acceso y el reparto de beneficios derivados de los recursos genéticos, incluyendo los patógenos, siguen siendo puntos de contención. Se necesitan mecanismos equitativos para asegurar que todos los países se beneficien de los avances científicos en la salud pública.
Investigación Futura:
Se necesitan investigaciones adicionales para abordar las siguientes áreas:
- Ampliar la base de evidencia sobre las relaciones entre biodiversidad, enfermedades y los impulsores del cambio global.
- Alinear las prioridades de investigación en ecología y ciencia de la biodiversidad con las prioridades de salud pública, centrándose en sistemas patógenos de alto riesgo y enfermedades tropicales desatendidas.
- Evaluar la eficacia de las intervenciones basadas en ecosistemas para reducir el riesgo de enfermedades.
Conclusión:
El artículo destaca la necesidad urgente de abordar la policrisis planetaria mediante la adopción de un enfoque integral que reconozca las interconexiones entre la pérdida de biodiversidad, la aparición de enfermedades y los impulsores antropogénicos. La ciencia de la biodiversidad juega un papel crucial en el desarrollo de soluciones para prevenir y mitigar los riesgos de futuras pandemias. La inversión en salud pública, el fortalecimiento de la gobernanza planetaria y la promoción de la colaboración internacional son fundamentales para proteger la salud humana y planetaria.
Cronología
A continuación, se presenta una cronología aproximada de los eventos principales mencionados en el artículo, centrándose en las pandemias y los hitos clave:
Siglo XIV:
- Peste Negra: La pandemia más mortífera de la historia, causada por la bacteria Yersinia pestis.
Siglos XVIII - XIX:
- Múltiples pandemias de cólera, causadas por la bacteria Vibrio cholerae.
Siglo XX:
- 1855-1960: Pandemia de peste, responsable de 12 a 15 millones de muertes.
- 1899-1923: Pandemia de cólera, con 1,5 millones de muertes.
- 1918-1920: Pandemia de influenza, conocida como "Gripe Española", causó 50 millones de muertes.
- 1957-1958: Pandemia de influenza, con 1,1 millones de muertes.
- 1961-presente: Pandemia de cólera, con 95.000 muertes al año.
- 1968-1969: Pandemia de influenza, con 1 a 4 millones de muertes.
- 1977-1979: Pandemia de influenza, con 700.000 muertes.
- 1981-presente: Pandemia del Virus de Inmunodeficiencia Humana (VIH), con 42 millones de muertes.
Siglo XXI:
- 2002: Emergencia del SARS-CoV, proveniente de la fauna silvestre.
- 2009-2010: Pandemia de influenza, con 123.000 a 230.000 muertes.
- Desde finales del siglo XX: Panzootia del hongo quítrido Batrachochytrium dendrobatidis, responsable de la extinción de al menos 90 especies de anfibios.
- 2013: Brote epidémico del MERS-CoV, transmitido de los animales a los humanos.
- 2020-presente: Pandemia de COVID-19, causada por el SARS-CoV-2, con 18 millones de muertes.
2024:
- Reunión de la Conferencia de las Partes (COP16) del Convenio sobre la Diversidad Biológica (CBD), donde se estableció el Fondo Cali para facilitar el reparto de los beneficios monetarios derivados del uso comercial de la biodiversidad.
- Negociaciones en la OMS para establecer un sistema de acceso y participación en los beneficios de los patógenos.
2025:
- Publicación del artículo "Patógenos y cambio planetario" en Nature Reviews Biodiversity.
Preguntas
¿Cuál es la relación entre la biodiversidad y las enfermedades infecciosas?
La biodiversidad y las enfermedades infecciosas están intrínsecamente vinculadas. La pérdida de biodiversidad puede aumentar el riesgo de aparición de enfermedades zoonóticas, aquellas que se transmiten de animales a humanos. Esto se debe a varios factores:
- Mayor diversidad de patógenos: Una mayor biodiversidad de especies hospederas suele conllevar una mayor diversidad de patógenos.
- Cambios en la dinámica de transmisión: La pérdida de biodiversidad puede alterar las interacciones entre especies, favoreciendo a aquellas que son más competentes para transmitir patógenos.
- Pérdida del efecto de dilución: La presencia de diversas especies puede "diluir" la prevalencia de patógenos, reduciendo el riesgo de transmisión. La pérdida de biodiversidad puede eliminar este efecto protector.
¿Cómo contribuyen las actividades humanas a la pérdida de biodiversidad y la aparición de enfermedades?
Las actividades humanas son los principales impulsores de la pérdida de biodiversidad y la aparición de enfermedades. Algunos de los factores clave incluyen:
- Cambio de uso de la tierra: La deforestación, la expansión agrícola y la urbanización fragmentan los hábitats y obligan a la vida silvestre a entrar en contacto más cercano con los humanos, aumentando el riesgo de transmisión de enfermedades.
- Agricultura: La agricultura intensiva crea grandes poblaciones de ganado, que pueden actuar como puentes para la transmisión de patógenos de la vida silvestre a los humanos.
- Cambio climático: El cambio climático altera los rangos geográficos de las especies y los patrones de transmisión de enfermedades, aumentando el riesgo de brotes en nuevas áreas.
- Uso de la vida silvestre: La caza, el comercio y el consumo de vida silvestre pueden aumentar el contacto entre humanos y animales, facilitando la transmisión de patógenos.
¿Cuáles son algunos ejemplos específicos de cómo la pérdida de biodiversidad ha llevado a la aparición de enfermedades?
- Enfermedad de Lyme: La fragmentación de los bosques ha favorecido a los ratones de patas blancas, que son reservorios competentes de la bacteria que causa la enfermedad de Lyme. La disminución de los depredadores también ha contribuido al aumento de la abundancia de ratones.
- Virus Hendra: La pérdida de hábitat y la urbanización han obligado a los zorros voladores australianos a establecerse en zonas urbanas, aumentando el contacto con los humanos y el riesgo de transmisión del virus Hendra.
- Coronavirus: Se cree que el comercio de vida silvestre desempeñó un papel importante en la aparición del SARS-CoV y el SARS-CoV-2, los virus responsables del SARS y el COVID-19, respectivamente.
¿Qué se puede hacer para prevenir futuras pandemias relacionadas con la pérdida de biodiversidad?
Abordar la pérdida de biodiversidad y el riesgo de pandemias requiere un enfoque multifacético que incluya:
- Conservación y restauración de ecosistemas: Proteger y restaurar los ecosistemas naturales puede ayudar a mantener la biodiversidad y reducir el riesgo de transmisión de enfermedades.
- Agricultura sostenible: La transición a prácticas agrícolas sostenibles puede reducir la presión sobre los ecosistemas naturales y disminuir el riesgo de transmisión de enfermedades del ganado a los humanos.
- Regulación del comercio de vida silvestre: La regulación del comercio de vida silvestre puede ayudar a prevenir el contacto entre humanos y animales que portan patógenos peligrosos.
- Vigilancia y respuesta temprana: Es esencial invertir en sistemas de vigilancia para detectar y responder rápidamente a los brotes de enfermedades.
¿Cómo puede la ciencia de la biodiversidad contribuir a los esfuerzos de vigilancia de enfermedades?
La ciencia de la biodiversidad proporciona datos y herramientas esenciales para la vigilancia de enfermedades, que incluyen:
- Identificación de especies hospederas y vectores: Los científicos pueden utilizar datos de biodiversidad para identificar las especies que tienen más probabilidades de albergar o transmitir patógenos.
- Mapeo de la distribución de especies: Los mapas de distribución de especies pueden ayudar a predecir dónde es más probable que surjan brotes de enfermedades.
- Monitoreo de cambios en la biodiversidad: El monitoreo de los cambios en la biodiversidad puede proporcionar señales de alerta temprana de posibles brotes de enfermedades.
¿Cuáles son algunos de los desafíos para integrar la biodiversidad en las políticas de salud global?
- Falta de coordinación: Existe una falta de coordinación entre las organizaciones y los acuerdos internacionales relacionados con la salud humana y la conservación de la biodiversidad.
- Brechas de datos: Hay importantes brechas de datos en nuestra comprensión de la relación entre la biodiversidad y las enfermedades, particularmente en los países de bajos ingresos.
- Financiación inadecuada: La financiación para la investigación y la vigilancia de enfermedades relacionadas con la biodiversidad es inadecuada.
¿Qué se está haciendo para abordar estos desafíos?
- Mayor colaboración: Hay un creciente reconocimiento de la necesidad de una mayor colaboración entre los sectores de la salud humana y la conservación de la biodiversidad.
- Nuevos mecanismos de financiación: Se están desarrollando nuevos mecanismos de financiación para apoyar la investigación y la vigilancia de enfermedades relacionadas con la biodiversidad.
- Desarrollo de políticas basadas en la ciencia: Se están realizando esfuerzos para desarrollar políticas de salud global que estén informadas por la ciencia de la biodiversidad.
¿Cuál es el papel de los individuos en la prevención de futuras pandemias?
Los individuos pueden desempeñar un papel importante en la prevención de futuras pandemias al:
- Apoyar los esfuerzos de conservación: Apoyar a las organizaciones que trabajan para proteger y restaurar los ecosistemas naturales.
- Reducir su impacto ambiental: Tomar medidas para reducir su huella ambiental, como reducir el consumo de carne y optar por productos sostenibles.
- Estar informado: Mantenerse informado sobre los riesgos de enfermedades relacionadas con la biodiversidad y tomar precauciones para evitar el contacto con animales que puedan portar patógenos.
Glosario de Términos Clave
- Arbovirus: Virus transmitido por artrópodos (como mosquitos o garrapatas).
- Enfermedad infecciosa emergente: Enfermedad infecciosa que ha experimentado recientemente una expansión de su rango de hospedadores, rango geográfico, impacto o incluso la atención de la investigación científica o la salud pública; este término es subjetivo y se utiliza con frecuencia de forma intercambiable con los términos enfermedades zoonóticas, transmitidas por vectores y transmitidas por el medio ambiente.
- Epidemia: Brote de enfermedad infecciosa en humanos, con una duración, tamaño o impacto significativos.
- Epizootia: Brote de enfermedad infecciosa en animales no humanos, con una duración, tamaño o impacto significativos.
- Competencia del hospedador: Capacidad de un hospedador para amplificar y transmitir la infección a otro hospedador o vector susceptible.
- Macroparásito: Parásitos que pueden observarse a simple vista, como garrapatas, pulgas y algunos gusanos; el término se utiliza a veces de forma intercambiable con el término parásitos.
- Microparásito: Parásitos microscópicos como bacterias, virus y algunos gusanos (por ejemplo, esquistosomas); el término se utiliza a veces de forma intercambiable con el término patógenos.
- Parásito: Organismo que existe en una relación simbiótica adversa con un hospedador.
- Parasitoide: Organismo que debe matar a un hospedador para completar su ciclo vital (por ejemplo, las avispas bracónidas).
- Patógeno: Microorganismo infeccioso que causa enfermedad en un hospedador.
- Reservorio: Hospedadores competentes que mantienen la transmisión del patógeno a nivel de población o comunidad.
- Transmisión inversa: Transmisión de patógenos de humanos a animales (también llamada zoonosis inversa).
- Derrame: Transmisión de patógenos de animales a humanos.
- Sinantrópico: Que vive junto a los humanos (por ejemplo, en ciudades o estructuras construidas por humanos).
Texto original
Traducción del texto original
- Artículo de revisión
- Publicado:
Patógenos y cambio planetario
Colin J. Carlson, Cole B. Brookson, Timothée Poisot
Nature Reviews Biodiversidad 1, 32–49 (2025)
Abstracto
Las enfermedades infecciosas emergentes, la pérdida de biodiversidad y el cambio ambiental antropogénico son crisis interconectadas con enormes costos sociales y ecológicos. En esta revisión, discutimos cómo los patógenos y parásitos están respondiendo al cambio global y las implicaciones para la prevención de pandemias y la conservación de la biodiversidad. Los principios ecológicos y evolutivos ayudan a explicar por qué tanto las pandemias como la mortandad de animales silvestres son cada vez más comunes; por qué el cambio en el uso de la tierra y la pérdida de biodiversidad suelen ir seguidos de un aumento de las enfermedades zoonóticas y transmitidas por vectores; y por qué algunas especies, como los murciélagos, albergan tantos patógenos emergentes. Para prevenir la próxima pandemia, los científicos deben centrarse en vigilar y limitar la propagación de un puñado de virus de alto riesgo, especialmente en interfaces clave como las granjas y los mercados de animales vivos. Pero para abordar el conjunto mucho más amplio de riesgos de enfermedades infecciosas asociados con el Antropoceno, los responsables de la toma de decisiones deberán desarrollar estrategias integrales que incluyan la vigilancia de patógenos en todas las especies y ecosistemas; intervenciones basadas en la conservación para reducir el contacto entre humanos y animales y proteger la salud de la vida silvestre; fortalecimiento del sistema de salud; y las mejoras mundiales en la preparación y respuesta ante epidemias. Los científicos pueden contribuir a estos esfuerzos llenando los vacíos globales en los datos sobre enfermedades y ampliando la base de evidencia para las relaciones entre las enfermedades y los impulsores de las enfermedades y las intervenciones ecológicas.
Puntos clave
Las actividades humanas han creado una policrisis planetaria que incluye pandemias, cambio climático y la sexta extinción masiva.
El cambio climático, el cambio de la tierra, la agricultura y el uso de la vida silvestre, las principales amenazas para la biodiversidad, también están impulsando un aumento mundial de las enfermedades infecciosas.
La pérdida de biodiversidad es generalmente perjudicial para la salud humana.
Las intervenciones dirigidas a las interfaces de contagio de patógenos de alto riesgo, como la gripe aviar o los coronavirus, podrían prevenir algunas pandemias futuras.
Incluso con estas intervenciones, las inversiones en sistemas de salud y preparación para pandemias serán una parte importante de la vida en el Antropoceno.
El mundo necesita una mejor infraestructura de biovigilancia en tiempo real para rastrear patógenos en todas las especies y ecosistemas.
Contenido similar visto por otros usuarios
Introducción
Una característica del Antropoceno es una disbiosis planetaria, en la que las relaciones ecológicas entre los huéspedes y los microorganismos cambian repentinamente, con consecuencias generalmente adversas para la salud humana, animal y del ecosistema. Los brotes de enfermedades infecciosas y los eventos de transmisión entre especies son fenómenos que ocurren de manera natural. Pero, al igual que con los cambios en el clima y la biodiversidad en los últimos cientos de años, la creciente diversidad y carga de las enfermedades infecciosas emergentes quedan fuera de las líneas de base históricas1,2. Durante la mayor parte de la historia de la humanidad, las pandemias fueron eventos "únicos en un siglo"; Desde principios del siglo XX, se han producido diez pandemias distintas, dos de ellas en los últimos quince años (recuadro 1). Cada año, varios virus nuevos llegan a las poblaciones humanas3, y la frecuencia de los eventos de contagio de patógenos de alto impacto aumenta en un 5% y la mortalidad resultante aumenta en un 9%4. Las poblaciones de animales no humanos también son cada vez más vulnerables a las enfermedades emergentes, con epizootias y panzootias de enfermedades como la quitridiomicosis que provocan oleadas de extinciones sin precedentes.
La creciente carga de enfermedades infecciosas emergentes es uno de los muchos cambios simultáneos e interconectados inducidos por el hombre en la biosfera1,5,6 (La fig. 1). La aparición de enfermedades infecciosas, la pérdida de biodiversidad y el calentamiento global antropogénico han mostrado tendencias similares en los últimos siglos. Los focos mundiales de enfermedades infecciosas emergentes parecen seguir gradientes clásicos de biodiversidad: han surgido nuevas enfermedades zoonóticas y transmitidas por vectores a un ritmo más rápido donde la biodiversidad de mamíferos también es alta7. Sin embargo, dentro de las comunidades ecológicas, la pérdida de biodiversidad de huéspedes y simbiontes también puede aumentar la transmisión de patógenos. La pérdida de biodiversidad y la aparición de enfermedades también comparten muchos factores aguas arriba, como la expansión agrícola, la pérdida de hábitat, el comercio de vida silvestre y el cambio climático. Juntos, estos cambios forman una "policrisis", una red interconectada de transformaciones que se aceleran rápidamente sin una solución única. La pandemia de COVID-19 puso estas conexiones en el centro de atención mundial en un grado sin precedentes8,9,10. A su paso, se han logrado algunos avances hacia la acción multilateral en materia de conservación de la biodiversidad y prevención de pandemias, lo que refleja un mayor reconocimiento de los vínculos entre la biodiversidad, la sostenibilidad y la salud humana. Sin embargo, las transformaciones planetarias han continuado en su mayoría como de costumbre, y el riesgo de futuras pandemias sigue creciendo.
a. El número anual de eventos de propagación de enfermedades zoonóticas de consecuencias graves aumentó considerablemente durante el siglo XX4, divergiendo de las líneas de base históricas, de manera similar a las tendencias temporales en las extinciones de especies241 (b) y el cambio climático c). Sin embargo, la tendencia aparente de las tasas de contagio podría atribuirse, al menos en parte, a las mejoras en la detección de brotes y la notificación de informes. d. Los informes de enfermedades infecciosas emergentes en humanos (los puntos de datos se codifican por tipo de patógeno) son más comunes en las regiones del mundo con mayor biodiversidad de mamíferos (número de especies de huéspedes zoonóticos); sin embargo, también es más probable que los brotes sean detectados por los sistemas de vigilancia y descritos por primera vez en Europa y América del Norte en comparación con otras regiones. Los efectos del cambio ambiental antropogénico se sienten en todo el mundo y, aunque las regiones con alta biodiversidad enfrentan riesgos únicos, la amenaza que representan las enfermedades infecciosas emergentes está creciendo en todas partes. Para una explicación completa de las fuentes de datos y cada componente específico de la figura, véase la Nota complementaria 2.
En esta revisión, sintetizamos el conocimiento actual sobre las conexiones entre la pérdida de biodiversidad y la aparición de enfermedades, sus impulsores antropogénicos compartidos y sus consecuencias para futuros riesgos de epidemias y pandemias. En primer lugar, presentamos perspectivas ecológicas sobre la relación multifacética entre la biodiversidad y las enfermedades infecciosas, incluyendo la evidencia de que la pérdida de biodiversidad puede ser un factor de riesgo para la aparición de enfermedades zoonóticas. A continuación, presentamos una perspectiva orientada a la salud pública sobre cómo se puede utilizar la ciencia de la biodiversidad para monitorear y gestionar las enfermedades infecciosas, y discutimos los desafíos abiertos asociados con la prevención de pandemias a través de la conservación de la biodiversidad. Concluimos describiendo cómo el trabajo futuro puede aclarar las conexiones entre el cambio ambiental antropogénico y la dinámica de las enfermedades infecciosas, para determinar qué soluciones basadas en la naturaleza podrían reducir el riesgo de pandemias.
Biodiversidad y enfermedades infecciosas
A pesar de décadas de llamamientos a la creación de marcos interdisciplinarios y síntesis, las perspectivas ecológicas sobre las enfermedades infecciosas siguen estando relativamente fragmentadas. Los macroecólogos y sistematólogos consideran que los parásitos y los patógenos son parte de la suma total de la biodiversidad, documentando patrones en dónde y cómo se ha acumulado la biodiversidad de parásitos11,12. Los ecólogos comunitarios exploran cómo las interacciones de las especies, los gradientes de biodiversidad e incluso la pérdida de biodiversidad dan forma a la dinámica de las enfermedades a lo largo del espacio y el tiempo13. Algunos biólogos conservacionistas estudian las enfermedades infecciosas emergentes como una amenaza creciente para la supervivencia de las especies, mientras que una comunidad de práctica más pequeña está trabajando para salvar al otro >99% de los parásitos que en su mayoría son inofensivos14,15. La perspectiva de Una Salud tiende un puente entre la biología de la conservación, la medicina veterinaria y la salud pública, centrándose en estrategias para reducir los riesgos de enfermedades infecciosas en las interfaces entre la vida silvestre, el ganado, los animales de compañía y los seres humanos. Mientras tanto, el enfoque de la salud planetaria hace hincapié en las conexiones entre la crisis climática, la sexta extinción masiva y las enfermedades infecciosas emergentes, y en cómo estas tendencias seguirán retroalimentándose mutuamente durante el próximo siglo. Cada una de estas perspectivas pinta un panorama ligeramente diferente de las enfermedades infecciosas emergentes, el papel de los impulsores antropogénicos y las posibles palancas ecológicas para la intervención. En esta sección, resumimos las principales perspectivas sobre la relación multifacética entre la biodiversidad y la enfermedad.
La biodiversidad del huésped impulsa la biodiversidad de patógenos
Los patógenos y parásitos representan una fracción sustancial de la biodiversidad mundial. El parasitismo ha evolucionado más de 200 veces en al menos 15 filos animales16: hay cientos de especies de garrapatas, miles de especies de pulgas, decenas de miles de especies de avispas parasitoides17, varios cientos de miles de especies de gusanos (un grupo polifilético) que parasitan huéspedes vertebrados18,19, y varios millones más de gusanos y ácaros que parasitan invertebrados20. La diversidad de microparásitos fúngicos, bacterianos y virales es aún más vasta, pero más difícil de cuantificar; Los microorganismos son difíciles de clasificar en especies discretas, y muchos cambian entre estados mutualistas, comensales o patógenos dependiendo de la composición del microbioma, la función inmunitaria o el contexto ecológico de su huésped.
La relación entre el huésped y la diversidad de parásitos o patógenos depende de la escala y del sistema. A escalas geográficas y taxonómicas amplias, la riqueza de especies hospedadoras se correlaciona estrecha y positivamente con la riqueza de especies de parásitos21,22. Este efecto de "la diversidad engendra diversidad" es el resultado de procesos tanto ecológicos como evolutivos. Cualquier parásito tiene un rango de huéspedes intrínseco finito, por lo que, en promedio, las comunidades de huéspedes más diversas pueden contener más parásitos posibles. Con el tiempo, los parásitos también se diversifican a través de una combinación de coespeciación y cambio de huésped, los cuales se ven facilitados por la diversificación del huésped22,23,24. Sin embargo, dentro de una comunidad o región ecológica determinada, el efecto de la riqueza del huésped sobre la riqueza del parásito puede ser secundario a la historia evolutiva del huésped, los rasgos del huésped (como el tamaño corporal o los fenotipos inmunes) y las condiciones ambientales (como el clima o el tipo de ecosistema)25,26.
Sobre la base de estos principios, también se supone que los puntos calientes tropicales de biodiversidad de vertebrados son puntos calientes de biodiversidad de parásitos y patógenos. Sin embargo, los datos disponibles no son en su mayoría adecuados para probar esta hipótesis, dada la pequeña fracción de diversidad de parásitos que se ha caracterizado y los sesgos geográficos y taxonómicos de la investigación subyacente (Recuadro 2). Por ejemplo, el descubrimiento de macroparásitos ha estado muy sesgado hacia los países de ingresos altos y medianos que invierten en investigación sistemática e infraestructura de recolección; Por lo tanto, los puntos críticos observados reflejan principalmente el esfuerzo y la capacidad de investigación18,27,28,29. El descubrimiento de virus ha tenido un sesgo similar hacia los países de ingresos altos, pero también ha sido moldeado en gran medida por las prioridades de salud pública, especialmente las inversiones a gran escala en la caracterización de virus con potencial zoonótico30,31. Como resultado, los esfuerzos de muestreo han sido idiosincrásicos, con una brecha considerable en la cuenca del Amazonas y, en general, en América Latina, en comparación con el África subsahariana y el sudeste asiático.
La biodiversidad impulsa la aparición de enfermedades
La gran mayoría de los patógenos animales nunca supondrán un riesgo para la salud humana, pero una pequeña fracción tiene la capacidad de infectar a los humanos, si se les da la oportunidad. A lo largo de las escalas de tiempo evolutivas, este es el origen de casi todas las enfermedades infecciosas humanas, con muy raras excepciones32,33. Más del 70% de las enfermedades infecciosas emergentes se han propagado de animales a humanos en los últimos cientos de años, y más de la mitad provienen de la vida silvestre (a diferencia del ganado o las mascotas). Entre los virus emergentes específicamente, casi el 90% son zoonóticos, y aproximadamente dos tercios son el resultado de la propagación de la vida silvestre33. (Sobre este punto, muchas fuentes utilizan citas incorrectas, estadísticas, o ambas cosas (Nota complementaria 1)). Los virus representan un riesgo único y continuo como patógenos zoonóticos potenciales, debido a su ritmo de diversificación, propensión a cruzar las barreras de las especies y potencial para causar epidemias devastadoras a partir de un solo caso humano. Se han registrado más de 500 especies de virus que infectan a huéspedes animales y humanos34, pero decenas o cientos de miles de virus de mamíferos (y un pequeño número de otros virus de vertebrados) podrían ser capaces de infectar a los humanos18,35.
Algunos grupos de animales parecen albergar un número desproporcionado de patógenos zoonóticos conocidos o potenciales. Una explicación propuesta para estos aparentes "hiper-reservorios" es que algunos clados de animales podrían albergar una mayor diversidad general de patógenos que otros: por ejemplo, los murciélagos comprenden el 22% de los mamíferos, pero albergan el 35% de los virus de mamíferos conocidos, mientras que los roedores comprenden el 36% de los mamíferos, pero solo representan el 19% de su diversidad viral. Sin embargo, estos patrones son casi imposibles de separar del esfuerzo de muestreo, especialmente en el caso de los murciélagos, que han sido el objetivo único de los esfuerzos de vigilancia del virus desde la aparición del SARS-CoV en 2002 (refs. 31,36). Aunque la riqueza viral por especie es similar en todos los órdenes de mamíferos22,37, algunos clados específicos tienen una diversidad de patógenos mayor de lo esperado; Esto podría ser un resultado aleatorio de la historia evolutiva, o el resultado de rasgos ecológicos específicos, como un ritmo de vida rápido o un rango geográfico más grande38.
Algunos clados animales también albergan patógenos con características únicas que aumentan su impacto potencial en las poblaciones humanas. Los murciélagos tienen adaptaciones inmunitarias particulares que parecen facilitar una tolerancia excepcional a los virus virulentos, como la expresión constitutiva de IFNα y una respuesta inflamatoria amortiguada39,40. Estos rasgos crean fuertes presiones selectivas sobre sus patógenos41, que podrían impulsar características que incluyen una mayor propensión a la transmisión entre especies y una mayor virulencia intrínseca, lo que explica por qué los murciélagos albergan muchos de los virus zoonóticos más virulentos42. Del mismo modo, los virus que están adaptados al sistema inmunitario de los primates pueden estar funcionalmente "preadaptados" a los humanos, por lo que es más probable que se transmitan después del primer caso humano42,43,44.
A escala global, los primeros registros de nuevas enfermedades infecciosas muestran una sorprendente correspondencia con los gradientes de biodiversidad de los mamíferos (Fig. 1d), con más enfermedades recientemente descritas en regiones con diversidad de mamíferos media a alta. Las nuevas enfermedades infecciosas también tienen más probabilidades de ser detectadas por los sistemas de vigilancia y caracterizadas por investigadores de los países de ingresos altos, especialmente en América del Norte y Europa; Después de ajustar estos sesgos, la correlación con los gradientes de biodiversidad se vuelve aún más fuerte7,33. La asociación entre una mayor biodiversidad del huésped y mayores tasas de aparición de enfermedades es el resultado de una mayor diversidad subyacente de la comunidad de patógenos, así como del gran número de personas y ganado que viven junto a ecosistemas biodiversos45. Sin embargo, hay excepciones a este patrón: en particular, el Neotrópico debería ser un punto caliente mundial de patógenos con potencial zoonótico dada su alta biodiversidad de mamíferos, pero los nuevos virus epidémicos parecen surgir de la vida silvestre muy raramente en América Latina y el Caribe46. Esta ausencia es particularmente notable en el caso de los murciélagos, que son más biodiversos en el Neotrópico; Sobre la base de la biogeografía de los clados que están estrechamente asociados con virus zoonóticos de alta consecuencia, el riesgo de contagio debería ser alto en la cuenca amazónica37,47,48,49. Sin embargo, hasta donde sabemos, no se ha registrado ninguna epidemia de un virus de origen murciélago en América del Sur. Este tipo de idiosincrasia en la relación entre la biodiversidad del huésped, la biodiversidad de patógenos y la aparición de enfermedades podría ser el resultado de una historia coevolutiva específica: por ejemplo, los filovirus (incluidos el virus del Ébola y el virus de Marburgo), los henipavirus (incluidos el virus Nipah y Hendra) y los coronavirus similares al SARS se han detectado en murciélagos en el Viejo Mundo, pero no en el Neotrópico (pero ver refs. 50,51), o podría deberse a diferentes presiones socioecológicas y vías para la emergencia (por ejemplo, los murciélagos podrían ser consumidos menos regularmente para obtener proteínas en las Américas, y la cría de vida silvestre es menos común que en el este y sudeste de Asia).
La pérdida de biodiversidad puede impulsar la aparición de enfermedades
Uno de los debates más extensos de la ecología contemporánea giró en torno a si la biodiversidad tiene un efecto protector contra las enfermedades infecciosas52. Este debate se ha resuelto en su mayor parte a través de un abrumador cuerpo de evidencia empírica y varios meta-análisis. En general, las diferencias entre las comunidades en la biodiversidad de huéspedes de referencia (en otras palabras, gradientes naturales de biodiversidad) tienen un efecto inconsistente —y, en las escalas espaciales más amplias, a menudo positivo— sobre el riesgo de enfermedad. Sin embargo, la pérdida de biodiversidad del huésped dentro de una comunidad ecológica determinada suele ir seguida de un aumento de la transmisión de patógenos53,54. Este hallazgo se ha reproducido en estudios observacionales y experimentales, con sistemas terrestres y marinos, hospederos animales y vegetales, patógenos transmitidos directamente y transmitidos por vectores, y diferentes tipos de agentes infecciosos54,55. Sin embargo, en cualquier caso dado, este patrón podría ser el resultado de una asociación indirecta (la pérdida de biodiversidad y la aparición de enfermedades pueden compartir un impulsor, como la pérdida de hábitat) o una causalidad directa (la pérdida de biodiversidad puede aumentar directamente la prevalencia de patógenos en la vida silvestre o las tasas de contagio).
La pérdida de biodiversidad no beneficia a todos los patógenos o parásitos por igual: algunos disminuyen o se pierden junto a sus huéspedes, mientras que otros se vuelven más frecuentes a medida que sus huéspedes o vectores se vuelven más abundantes. El destino de cualquier patógeno depende de la competencia del huésped de cada especie huésped disponible, de sus interacciones entre sí y de sus respuestas a las perturbaciones antropogénicas. En general, el cambio antropogénico aumentará el riesgo de enfermedad si favorece a las especies hospedadoras que son importantes para la transmisión de patógenos, o si conduce a la pérdida de otras especies. Por ejemplo, la pérdida de un depredador clave podría dar lugar a poblaciones de presas más grandes y conectadas, lo que aumentaría la transmisión de patógenos (el "efecto de las manadas sanas")56,57,58. Del mismo modo, si los cambios ambientales conducen a la pérdida desproporcionada de huéspedes de baja competencia (es decir, aquellos que sirven como sumidero o callejón sin salida para la transmisión), la prevalencia puede aumentar en las especies restantes (el «efecto de dilución»)59,60. Por ejemplo, la fragmentación del bosque favorece al ratón de patas blancas (Peromyscus leucopus)61, que es un huésped altamente competente tanto para la bacteria que causa la enfermedad de Lyme como para las garrapatas que la transmiten; Mientras tanto, los huéspedes de menor competencia, como las zarigüeyas, se vuelven menos abundantes en paisajes perturbados62. La universalidad del efecto de dilución y su relevancia para la salud humana han sido objeto de un intenso debate, pero en todos los ecosistemas, las especies que son más resistentes al cambio antropogénico también tienen más probabilidades de ser huéspedes de enfermedades zoonóticas38,63. Hay varias explicaciones para este patrón, pero muchas se centran en la historia de la vida: los animales de vida rápida que prosperan en entornos perturbados (especies "malezas" como el ratón de patas blancas) a menudo experimentan ciclos poblacionales explosivos que crean episodios de alto riesgo de contagio64, y también podría estar sujeto a compensaciones evolutivas en la inversión inmunitaria65,66,67.
No todos los parásitos responden positivamente a los cambios antropogénicos. Los parásitos son vulnerables a la pérdida de sus huéspedes68,69,70, pero también pueden verse directamente afectados por factores estresantes ambientales que influyen en la transmisión o la supervivencia, especialmente en sus etapas de vida libre71,72,73. Paradójicamente, las disminuciones en la riqueza total de parásitos pueden ir acompañadas de un mayor riesgo de enfermedad por patógenos específicos. A veces, esta disminución ocurre porque los parásitos están en competencia directa, no solo dentro de las poblaciones de huéspedes, sino también dentro de los huéspedes individuales (en otras palabras, la coinfección conduce a peores resultados de la enfermedad para el huésped, limitando la transmisión del parásito con altas prevalencias)74,75. En otros casos, las interacciones complejas entre la infección del parásito y la inmunidad del huésped pueden reducir la susceptibilidad del huésped a la infección con un patógeno más virulento73,76. Por lo tanto, las estrategias de conservación que conservan de forma proactiva a los huéspedes junto con una fauna parásita diversa podrían ayudar a protegerlos de la aparición de enfermedades que pongan en peligro su supervivencia o incluso su salud humana77. Sin embargo, el campo de la biología de la conservación de parásitos y la comprensión científica más amplia de las consecuencias ecológicas de la pérdida de biodiversidad de parásitos aún está en pañales.
Las enfermedades pueden provocar la pérdida de biodiversidad
Las enfermedades infecciosas emergentes plantean un problema creciente para la conservación de la vida silvestre78, con ejemplos muy destacados de mortalidad masiva como consecuencia de la introducción de nuevos patógenos o de brotes inusuales de patógenos endémicos provocados por condiciones ambientales cambiantes79. Por ejemplo, durante un clima inusualmente cálido y húmedo en 2015, un brote de una bacteria endémica y generalmente benigna (Pasteurella multocida) en Kazajstán fue responsable de la pérdida del 60% de la población mundial de antílope saiga (Saiga tatarica)80,81. Solo dos años después, el virulento virus de la peste de los pequeños rumiantes se propagó del ganado al saiga en Mongolia, lo que provocó la pérdida del 80% de la población local82.
Las epizootias de patógenos virulentos suelen ser autolimitadas (a medida que disminuye el número de huéspedes susceptibles, los huéspedes infectados acaban muriendo más rápido de lo que producen infecciones secundarias) y, de forma aislada, es poco probable que causen la extinción de una especie entera83. Sin embargo, las enfermedades infecciosas pueden reducir fácilmente las poblaciones de vida silvestre a niveles bajos, donde enfrentan un mayor riesgo de extinción debido a otros factores; Por el contrario, las poblaciones pequeñas y aisladas, como las especies endémicas de las islas, pueden ser vulnerables a la extinción total inducida por enfermedades.
Un subconjunto de patógenos también puede continuar propagándose a través de los reservorios ambientales, incluso cuando las poblaciones de huéspedes alcanzan niveles críticamente bajos84. De hecho, varias extinciones prominentes de animales salvajes inducidas por enfermedades se atribuyen a patógenos fúngicos que pueden persistir en el medio ambiente. Desde finales del siglo XX, una panzoótica del hongo quítrido Batrachochytrium dendrobatidis ha sido responsable de la extinción de al menos 90 especies de anfibios85. Otro hongo quítrido, B. salamandrivorans, ha sido responsable de eventos de mortalidad masiva en algunas poblaciones de salamandras europeas86 y algún día podría convertirse en un problema global similar87. El hongo responsable del síndrome de la nariz blanca (Pseudogymnoascus destructans) ha provocado de manera similar el colapso de las poblaciones de murciélagos de América del Norte, con al menos una especie aún en riesgo de extinción88. Estos patógenos han tenido repercusiones inesperadas para la salud humana: la pérdida de anfibios neotropicales que se alimentan de larvas de mosquitos podría haber aumentado la incidencia de malaria en Costa Rica y Panamá89, y la pérdida de murciélagos insectívoros podría haber obligado a los agricultores a usar más insecticida, lo que llevó a tasas más altas de mortalidad infantil en el este de los EE. UU90.
A partir del 2020, el sublinaje 2.3.4.4b de influenza aviar A/H5NX altamente patógena ha sido responsable de numerosos eventos de mortalidad masiva en aves y mamíferos silvestres91, que representa una amenaza panzoótica potencialmente sin precedentes. En 2023, el 27% de la población total de pingüinos de Humboldt chilenos (Spheniscus humboldti) fueron encontrados muertos, lo que representa un aumento de casi el 2.000% en la mortalidad en lo que va del año92. Después de que varios cóndores de California (Gymnogyps californianus) en peligro crítico de extinción murieran a causa de la gripe aviar en 2023, se iniciaron esfuerzos rápidos para desarrollar una vacuna de emergencia.
Los patógenos humanos también representan un riesgo creciente para la salud de la vida silvestre. El contagio de patógenos de humano a animal está limitado por los mismos cuellos de botella ecológicos y evolutivos que el contagio zoonótico, así como por la asimetría de muchas interacciones entre humanos y animales (por ejemplo, los humanos comen a otros animales con una frecuencia mucho mayor que a la inversa). Sin embargo, así como las tasas de contagio están creciendo exponencialmente, el derrame también podría ser un problema creciente. Este fenómeno es quizás más visible en la propagación global del SARS-CoV-2, que se ha encontrado en 35 especies animales en los 5 continentes93. Mientras que el SARS-CoV-2 generalmente ha tenido efectos mínimos en la conservación, en otros casos, los resultados de la propagación del patógeno han sido graves. Por ejemplo, los primates parecen ser más vulnerables a múltiples infecciones humanas que otros mamíferos debido a su proximidad evolutiva a los humanos94, y los patógenos respiratorios que son relativamente benignos en los seres humanos (por ejemplo, los virus del «resfriado común») suelen causar graves muertes en los grandes simios95,96. Los primates que viven en santuarios o que se habitúan a los paisajes humanos parecen estar particularmente en riesgo94, pero el efecto sobre las poblaciones naturales aún puede ser sustancial.
Las medidas de conservación que limitan el contacto entre humanos y vida silvestre son la principal defensa contra el contagio de patógenos. La vigilancia de la mortalidad de la fauna silvestre y la vigilancia activa de patógenos son especialmente importantes cuando los seres humanos conviven con especies de fauna silvestre o están ampliando su alcance a hábitats críticos para especies amenazadas. La inversión en la salud humana y ganadera alrededor de las áreas protegidas también puede limitar el nivel de exposición que enfrenta la vida silvestre97. Estas medidas, a su vez, reducen los riesgos y efectos del desbordamiento zoonótico en zonas de alta biodiversidad.
Impulsores comunes y vías causales
Los mismos procesos antropogénicos que son responsables de la crisis de la biodiversidad también están implicados como los principales impulsores ecológicos de la aparición de enfermedades9,98,99,100,101. Tanto el cambio terrestre como el climático median la dinámica de las enfermedades a través de la fisiología y el comportamiento de los organismos, y la agricultura y el comercio de vida silvestre y la caza actúan como interfaces distintas de alto riesgo para la transmisión de patógenos de animales a humanos. Sin embargo, el efecto y la importancia de cualquier impulsor de la pérdida de biodiversidad o la aparición de enfermedades, y la relación entre ambos, pueden ser únicos para un patógeno determinado, e incluso para un paisaje determinado. Poner estas conexiones en contexto puede ayudar a los investigadores a producir mejores evaluaciones de riesgos e identificar puntos de intervención.
Controladores ascendentes
Desde la década de 1960, un tercio de la superficie terrestre mundial ha sufrido cambios antropogénicos102, en forma de conversión y fragmentación de bosques intactos y otros ecosistemas, de expansión e intensificación agrícola y de urbanización. La pérdida de hábitat debido al cambio de la tierra (y, cada vez más, al cambio climático) es la mayor amenaza para la biodiversidad103. El cambio de tierras también se cita a menudo como el principal impulsor del desbordamiento zoonótico104. La pérdida, fragmentación y degradación del hábitat pueden causar estrés nutricional y cambios de comportamiento que aumentan el contacto dentro de las especies y entre ellas, todo lo cual puede conducir a una mayor transmisión de patógenos104.105 (La fig. 2a). La pérdida de hábitat también empuja a la vida silvestre a los paisajes utilizados por el hombre para buscar recursos, refugio o espacio63.106 , lo que aumenta el riesgo de contagio.
La pérdida de biodiversidad y la aparición de enfermedades a menudo siguen a la conversión de la tierra, pero las diferentes escuelas de pensamiento ofrecen diferentes perspectivas sobre los mecanismos subyacentes. a, En un modelo conceptual basado en la ecoinmunología y la ecología de comunidades104.105, la conversión de tierras desencadena una cascada de cambios a nivel de organismos y comunidades; Con el tiempo, esto aumenta el riesgo de propagación zoonótica. b, En un modelo conceptual basado en la ecología del paisaje y la teoría de los sistemas socio-ecológicos63.107 , el riesgo de contagio está determinado por la intensidad y el tipo de uso antropogénico de la tierra, los requisitos de hábitat de especies importantes en el ciclo de vida del patógeno y los tipos de interfaz asociados con el contagio (por ejemplo, la caza de fauna silvestre o la agricultura). Algunas variables suelen estar correlacionadas positiva o negativamente a lo largo del espacio con el grado de perturbación antropogénica; Otros gradientes pueden ser exclusivos de la ecología de un paisaje y un patógeno determinados. Ninguno de los dos modelos es integral ni universal, y ambos son compatibles con otras perspectivas.
La respuesta de un patógeno determinado al cambio de tierra depende de su ecología de transmisión. Los casos humanos de zoonosis transmitidas por vectores (como el virus de la fiebre amarilla) parecen aumentar de manera más sistemática después del cambio de uso de la tierra que la propagación de patógenos transmitidos directamente (como el virus del Ébola)5.107. Sin embargo, el riesgo también puede disminuir después de la conversión de la tierra si los huéspedes o vectores clave de la vida silvestre no se adaptan bien a los paisajes alterados por el hombre o son excluidos por especies sinantrópicas54.108.109 (La fig. Por lo tanto, la conversión de tierras a veces se asocia con un cambio de régimen entre diferentes conjuntos de patógenos humanos. Por ejemplo, en Brasil, la transición de los paisajes rurales a los urbanos va acompañada de un cambio de la malaria y la leishmaniasis a arbovirus como el dengue y el virus del Zika, que son transmitidos principalmente por el mosquito Aedes aegypti109.
Además de ser el mayor impulsor de la deforestación, la ganadería presenta riesgos únicos en relación con otros tipos de uso de la tierra. De las cuatro facetas del cambio planetario discutidas aquí, la agricultura tuvo el efecto más temprano (y más prolongado) en la aparición de enfermedades; Los humanos y los animales domésticos han tenido miles de años para compartir virus110. La ganadería también aporta más biomasa terrestre (alrededor de 630 millones de toneladas) que los seres humanos (alrededor de 390 millones de toneladas) o los mamíferos silvestres (alrededor de 20 millones de toneladas)111; Esta abundancia crea amplias oportunidades para la circulación de patógenos, la evolución (incluida la adaptación al sistema inmunológico de los mamíferos) y el contacto entre especies. Por lo tanto, el ganado a menudo actúa como huésped puente o de amplificación en el proceso de aparición de la enfermedad112,113,114. Por ejemplo, en casi la mitad de todas las pandemias modernas, los subtipos emergentes del virus de la influenza infectaron a las aves de corral u otro ganado antes de propagarse a los humanos. El ganado también puede ser una fuente de patógenos que amenazan a las poblaciones de vida silvestre, como la influenza aviar altamente patógena o la tuberculosis115.
En comparación con el cambio de la tierra, el cambio climático a menudo se subestima como una amenaza tanto para la biodiversidad como para la salud humana, tanto porque los riesgos relacionados con el clima siguen acelerándose como porque pueden ser difíciles de distinguir de otras tendencias correlacionadas, incluida la mejora de la vigilancia. El aumento de las temperaturas, los cambios en las precipitaciones y las tormentas severas podrían ser responsables del aumento del riesgo de más de la mitad de las enfermedades humanas116. Hasta ahora, el efecto mejor conocido del cambio climático sobre el riesgo de enfermedades ha sido un aumento en la carga global de enfermedades transmitidas por mosquitos, que exhiben una relación unimodal de transmisión-temperatura bien caracterizada117,118,119. El cambio climático también está implicado como un factor contribuyente a la rápida expansión del área de distribución de los mosquitos vectores de la malaria y el dengue120.121 y también se sospecha de efectos similares en las garrapatas, pero menos claramente establecidos122.123. Los cambios en el área de distribución geográfica impulsados por el cambio climático también están creando nuevas oportunidades para el contacto interespecífico entre la vida silvestre124.125, aumentando los riesgos relacionados con las epizootias y creando posibles huéspedes puente para la emergencia zoonótica126. En sus áreas de distribución nativas, muchas especies también están cada vez más expuestas a temperaturas extremas que nunca antes habían encontrado127.128, que suponen un grave riesgo para la supervivencia de las especies y la estabilidad de los ecosistemas; Las implicaciones para la transmisión de enfermedades apenas se han explorado.
Un último impulsor planetario de la pérdida de biodiversidad y las enfermedades emergentes es el uso de la vida silvestre, incluidos el comercio, la agricultura y la caza. Hasta ahora, los casos humanos de menos del 10% de los virus emergentes se han rastreado hasta el uso de animales silvestres112, pero algunos de estos virus plantean un riesgo particularmente grave, en particular, los coronavirus similares al SARS en el sudeste asiático129,130,131,132. El comercio de vida silvestre afecta a una cuarta parte de las especies de vertebrados y se ha convertido en una amenaza importante para la supervivencia de muchas especies133. Las granjas de vida silvestre, las cadenas de suministro y los mercados de animales vivos crean condiciones antinaturales que pueden aumentar el hacinamiento y el estrés fisiológico, lo que lleva a tasas más altas de infección134.135 así como patrones de contacto inusuales entre especies136. Cada etapa del proceso de comercio de vida silvestre comercial también implica un contacto de alto riesgo entre humanos y animales, y es más probable que los eventos de contagio provoquen epidemias si se llevan especies silvestres comercializadas a grandes centros de población. Aunque generalmente es de menor riesgo que el comercio de vida silvestre, la caza de subsistencia también puede amenazar la supervivencia de las especies137.138 y crear oportunidades para el contagio de patógenos.
Aunque el cambio de la tierra, la agricultura, el cambio climático y el uso de la vida silvestre son los impulsores ecológicos más importantes de la pérdida de biodiversidad y la aparición de enfermedades54, se sabe que varias otras facetas del cambio antropogénico afectan, en casos más limitados, a ambos procesos. Las especies exóticas invasoras están involucradas en el 60% de las extinciones modernas139y puede llevar patógenos a nuevas regiones. Por ejemplo, dos mosquitos invasores a nivel mundial (A. aegypti y Aedes albopictus) se han convertido en los principales vectores de varios arbovirus, como el dengue, la fiebre amarilla, el chikungunya y el virus del Zika121.140. Un tercer mosquito sinantrópico del sur de Asia (Anopheles stephensi) plantea ahora un riesgo similar de invasión mundial y representa una amenaza creciente para la erradicación de la malaria en África141.142. La contaminación por plaguicidas puede causar cambios en el ecosistema que aumentan el riesgo de enfermedades; Por ejemplo, la escorrentía de fertilizantes favorece a las malezas acuáticas invasoras, que crean un hábitat para los caracoles vectores de la esquistosomiasis143. Por último, la fuga de antibióticos al medio ambiente es uno de los principales contribuyentes a la crisis mundial de bacterias y hongos resistentes a los antimicrobianos144.145, seleccionando para la aparición de virus pandémicos resistentes a los medicamentos antes de que se propaguen de los animales a los seres humanos146.147.
Estudios de caso sobre la causalidad
No existe una relación canónica entre la biodiversidad, la enfermedad y el impulsor (Fig. 3). Para ilustrar la diversidad de estas interacciones, discutimos cuatro estudios de caso que ejemplifican cómo la variación en el modo de transmisión de patógenos, en la identidad del huésped o vector de la vida silvestre y en el contexto antropogénico puede influir en la dinámica de la aparición de enfermedades.
a) La pérdida de biodiversidad puede impulsar la aparición de enfermedades, y viceversa; También comparten muchos de los mismos controladores ascendentes. Tres de estas facetas del cambio global antropogénico están estrechamente vinculadas: la agricultura es el principal impulsor del cambio de tierras, y la agricultura y el cambio de tierras son los principales impulsores del cambio climático. La fuerza y la dirección de estas relaciones varían sustancialmente de una enfermedad a otra; Se muestran estudios de casos para la enfermedad de Lyme (b), el virus de Hendra (c), la influenza (d) y los coronavirus (e). En b-e, las líneas continuas indican relaciones respaldadas por evidencia directa de la literatura, y las líneas discontinuas indican relaciones que son hipotéticas pero débilmente respaldadas, o que tienen más probabilidades de ser importantes en el futuro. Para mitigar los riesgos de enfermedades infecciosas, los científicos deben establecer este tipo de relaciones e identificar intervenciones caso por caso que se dirijan a los impulsores adecuados.
Enfermedad de Lyme
La enfermedad de Lyme es causada por la bacteria Borrelia burgdorferi, y transmitida principalmente por la garrapata de patas negras (Ixodes scapularis). Desde que se identificó por primera vez en 1975, la incidencia de la enfermedad de Lyme ha crecido sustancialmente, principalmente en las regiones noreste y medio oeste de los Estados Unidos. El cambio de tierras y la pérdida de biodiversidad han contribuido a esta tendencia: la fragmentación de los bosques ha llevado directamente a la pérdida de huéspedes de baja competencia, como las zarigüeyas, mientras que favorece a los reservorios competentes, como los ratones, las ardillas listadas y las musarañas61,62,148. Además, la disminución de especies depredadoras clave, como los zorros rojos, también ha aumentado la abundancia de estos huéspedes competentes58. Aunque el cambio climático no ha sido el principal impulsor, la creciente carga de la enfermedad de Lyme en el noreste de EE.UU. es atribuible, al menos en parte, al aumento de las temperaturas, y es probable que siga aumentando con el calentamiento futuro149.
Virus Hendra
El virus Hendra es un patógeno de los zorros voladores australianos (Pteropus spp.); El contagio a los seres humanos ocurre con poca frecuencia y no conduce a una transmisión posterior. Las interacciones entre humanos y murciélagos han aumentado a medida que los hábitats invernales de los murciélagos se han convertido en tierras agrícolas, y las poblaciones previamente nómadas se han asentado en entornos urbanos, lo que crea más oportunidades para el contagio del virus Hendra106. La pérdida del comportamiento nómada también reduce la conectividad de la población y, por lo tanto, permite que la inmunidad disminuya, lo que lleva a epidemias de mayor tamaño tras la reintroducción viral106.150. Es probable que la dinámica de la transmisión también se vea afectada por el cambio climático. Las oscilaciones climáticas de El Niño crean años en los que los recursos frutales son insuficientes, lo que lleva a los murciélagos a las tierras agrícolas para alimentarse; Este estrés nutricional también aumenta las pulsaciones estacionales de excreción viral106.151. La pérdida de hábitat a causa de incendios forestales extensos podría provocar riesgos similares152. Finalmente, el calor extremo asociado con el cambio climático mató a más de 72,000 murciélagos y causó el abandono generalizado de cachorros en el verano de 2019-2020 (ref. 153); Las implicaciones de este tipo de evento de mortalidad para la dinámica de la enfermedad son inciertas.
Influenza
El virus de la gripe A es el patógeno arquetípico con potencial pandémico y, cada vez más, una amenaza mundial para la biodiversidad91.154 . Las cepas virales experimentan una deriva genética y una recombinación en las aves de corral y otros animales, que también transmiten el virus a las aves silvestres y a los seres humanos. Aunque los esfuerzos de vigilancia y prevención a menudo se centran en las granjas, también se han asociado con los mercados de aves de corral y el comercio de aves silvestres, particularmente en China y el sudeste asiático155.156. Los impulsores antropogénicos de la circulación de la influenza en aves silvestres están comparativamente poco estudiados. La pérdida precipitada de los humedales del mundo podría estar obligando a las aves acuáticas migratorias a congregarse en parches más pequeños de hábitat intacto, lo que llevaría a niveles más altos de transmisión157.158; Las áreas protegidas podrían reducir el riesgo de brotes al reducir esta presión y separar las aves acuáticas de las aves de corral domésticas. A pesar de las especulaciones de que el cambio climático podría ser un factor contribuyente a la panzootia de la gripe aviar altamente patógena H5NX159, hasta el momento no hay evidencia que apoye esta hipótesis.
Coronavirus
Los Coronaviridae son una familia inmensamente diversa de virus que se encuentran en mamíferos y aves, aunque algunos grupos que se han diversificado en murciélagos (particularmente los subgéneros Sarbecovirus y Merbecovirus) representan un riesgo distinto para la salud humana. Hasta ahora, han surgido menos de una docena de coronavirus en humanos, de los cuales solo tres han mostrado una alta patogenicidad y potencial pandémico: dos coronavirus del síndrome respiratorio agudo grave (SARS-CoV y SARS-CoV-2) y el coronavirus del síndrome respiratorio de Oriente Medio (MERS-CoV). La evidencia más sólida disponible indica que el SARS-CoV y el SARS-CoV-2 llegaron a los humanos a través del comercio de vida silvestre129.160.161, que también representa una grave amenaza para la conservación de presuntos huéspedes de vida silvestre. Sin embargo, se sabe o se sospecha que la mayoría de los coronavirus humanos, incluidos el MERS-CoV, varios virus de baja patogenicidad y las adiciones más recientes, el coronavirus canino y el deltacoronavirus porcino, han llegado a los humanos a través del ganado y los animales de compañía162.163.164. Conexiones propuestas entre el origen específico de la COVID-19 y el cambio de tierras165 o el cambio climático166 son hasta ahora especulativas. Sin embargo, la prevalencia del coronavirus es mayor en contextos relacionados con el uso de la vida silvestre134.135 y en ecosistemas con mayor huella humana167. Un estudio encontró evidencia prometedora de un efecto de dilución en el sistema de murciélagos y coronavirus en África occidental168, pero se necesita más trabajo para establecer si la variación interespecífica en la inmunología contribuye a las diferencias en la competencia del huésped y si, por lo tanto, la biodiversidad podría tener un efecto protector.
Soluciones compartidas para la biodiversidad y la salud
En los próximos 25 años, el mundo está en camino de un calentamiento de al menos 1,5 °C y casi 300 millones de hectáreas de deforestación tropical169. Al mismo tiempo, sobre la base de las tendencias actuales, se prevé un aumento de cuatro veces en la tasa de contagio zoonótico, con 12 veces más muertes4. Estos problemas exigen un conjunto diverso de soluciones, que varían en escala a partir de iniciativas locales170 a la gobernanza planetaria171.172. Las perspectivas de la ecología y la ciencia de la biodiversidad pueden aprovecharse para desarrollar una mejor infraestructura de vigilancia y estrategias basadas en los ecosistemas para la prevención de brotes, junto con inversiones renovadas en salud pública y preparación y respuesta ante brotes.
Biovigilancia y seguimiento de la biodiversidad
La vigilancia es la columna vertebral de la salud pública. El enfoque de «Una sola salud» destaca la importancia de monitorear los patógenos no solo en los seres humanos, sino también en la vida silvestre, los animales domésticos y los reservorios ambientales como el suelo, el agua y el aire. Dadas las limitaciones de recursos, los esfuerzos de vigilancia deben centrarse en los huéspedes y las interfaces más asociados con riesgos específicos de epidemias o pandemias, o en las principales lagunas de datos que limitan la inferencia científica. Los modelos de aprendizaje automático también pueden ayudar a dirigir los esfuerzos de muestreo y monitoreo hacia las especies que tienen más probabilidades de albergar patógenos no descubiertos48,49,173, corren el mayor riesgo de contraer el virus174.175, o es probable que muestren comportamientos relevantes para los efectos indirectos, como vivir en estructuras construidas por el hombre176.
Varios avances tecnológicos están mejorando la vigilancia de las enfermedades de la fauna silvestre. Por ejemplo, aplicaciones móviles como Spatial Monitoring and Reporting Tool (SMART)177 permitir que los guardaparques reporten eventos de mortalidad inusuales. Plataformas como el Observatorio Armonizado de Patógenos de Verena178 y la Asociación de Intercambio de Información sobre la Salud de la Vida Silvestre del Servicio Geológico de los Estados Unidos179 Permita que los investigadores y administradores compartan datos sobre enfermedades de la fauna silvestre en tiempo real. Los métodos de muestreo no invasivos también abren nuevos horizontes para la biovigilancia: por ejemplo, las muestras de aire recogidas por drones pueden utilizarse para monitorizar mamíferos marinos180 o para tomar muestras de mercados de animales vivos o dormideros de murciélagos sin poner a los investigadores en riesgo de exposición a patógenos181. El advenimiento de la "biomonitorización de próxima generación"182,183,184, con su adopción explícita del análisis de imagen y sonido mejorado por inteligencia artificial, así como la recopilación de datos de ADN y ARN ambientales, también está aumentando el volumen y la resolución de los datos que se pueden recopilar.
La ciencia de la biodiversidad también se ha convertido en una fuente crítica de datos para la investigación y la práctica de la salud pública185. Los datos geoespaciales sobre los huéspedes y vectores de enfermedades se utilizan regularmente para cartografiar el riesgo de transmisión de enfermedades186.187, para identificar las lagunas de vigilancia188, para reconstruir patrones históricos, como la propagación de vectores invasores120.121, y proyectar el riesgo futuro de enfermedades infecciosas en diferentes escenarios de cambio climático y uso de la tierra126.189.190. Los repositorios de biodiversidad suelen ser la mejor fuente disponible de estos datos, aunque los microorganismos siguen estando infrarrepresentados en las principales plataformas de datos sobre biodiversidad191 (La fig. 4a). Esfuerzos específicos para reclutar nuevos datos192.193, en particular de fuentes enriquecidas, como proyectos científicos comunitarios (por ejemplo, la aplicación Mosquito Alert)194.195 y organismos de control de vectores196, aumentan el valor de estos conjuntos de datos para la salud pública y para la investigación en biodiversidad en general.
a) Registros geolocalizados de presencia de Aedes aegypti, el principal vector urbano de varios virus, entre ellos el dengue, la fiebre amarilla y el zika. b, Registros geolocalizados de presencia de murciélagos de herradura (Rhinolophus spp.), el principal reservorio de vida silvestre conocido de coronavirus similares al SARS. La información contenida en la infraestructura digital de la biodiversidad y las colecciones de los museos es tanto un recurso fundamental para la investigación ecológica a largo plazo como una fuente abierta de inteligencia epidémica en tiempo real y descubrimiento viral. La fotografía en a es una reimpresión de https://www.gbif.org/occurrence/3910014308, CC0 (https://creativecommons.org/publicdomain/zero/1.0/legalcode); la fotografía en b es una reimpresión de https://www.gbif.org/occurrence/2432534405, CC0 (https://creativecommons.org/publicdomain/zero/1.0/). GBIF, Centro Global de Información sobre Biodiversidad.
Las colecciones de los museos también pueden apoyar la investigación basada en especímenes sobre enfermedades infecciosas197,198,199: al diseccionar animales preservados, los investigadores pueden rastrear las tendencias a largo plazo en sus comunidades de parásitos e incluso probar hipótesis sobre factores como el cambio climático71.200.201. Los tejidos preservados también se pueden utilizar para descubrir patógenos no caracterizados, incluso de especies que de otro modo serían difíciles de muestrear (por ejemplo, especies raras y en peligro de extinción)202.203 (La fig. 4b).
Gestión de los riesgos de enfermedades infecciosas
La salud pública y la conservación pueden beneficiarse de intervenciones que reduzcan la transmisión de patógenos dentro de las poblaciones de vida silvestre o limiten las oportunidades de transmisión entre especies en la interfaz entre la vida silvestre, el ganado y los seres humanos. Muchas estrategias de prevención de contagios orientadas a la salud pública incluyen un componente educativo centrado en vivir de manera segura junto a la vida silvestre204, especialmente cuando las comunidades podrían depender de intervenciones destructivas como los sacrificios, que dañan a las poblaciones de vida silvestre y pueden aumentar inadvertidamente el riesgo de contagio205,206,207. Otras estrategias activas incluyen la vacunación de la fauna silvestre y el ganado o el control de especies invasoras208.
Los ecologistas también han pedido intervenciones basadas en los ecosistemas que se centren en los impulsores de la aparición de enfermedades. Ejemplos de estas estrategias incluyen decisiones de manejo de la tierra que preservan bosques intactos, respaldadas por la preponderancia de la evidencia de que la pérdida y fragmentación de los bosques a menudo van seguidas de un aumento en el riesgo de contagio zoonótico. Otras estrategias que apuntan a revertir los cambios en los ecosistemas, como la forestación y la reforestación106.209.210 o quemaduras prescritas211, podría lograr resultados similares, pero solo hay una pequeña cantidad de investigación primaria que prueba esta suposición.
Entre la gama de intervenciones para restaurar los ecosistemas y reducir los riesgos de enfermedades infecciosas, las intervenciones más exitosas para la conservación y la salud humana son aquellas que están motivadas por un conocimiento detallado de la dinámica del sistema, a menudo a partir de estudios de casos a largo plazo106; que impliquen un diseño y una toma de decisiones liderados localmente, alineados con las prioridades comunitarias preexistentes; y que sean de bajo costo o, mejor aún, alineados con los incentivos económicos existentes208.212.213. Sin estos factores, las intervenciones suelen ser menos exitosas y podrían tener consecuencias negativas no deseadas para la salud humana, la conservación o ambas, como en el caso de la pesca con mosquiteros214, o restricciones infructuosas a la caza de fauna silvestre y a los mercados de animales vivos215.216.
Las estrategias ecológicas son solo una parte de una estrategia eficaz para combatir las enfermedades infecciosas emergentes. Aunque las narrativas populares a menudo enmarcan el desbordamiento como la consecuencia directa de las relaciones desordenadas entre los seres humanos y la naturaleza217.218, las personas también están expuestas regularmente a enfermedades zoonóticas y transmitidas por vectores simplemente por convivir con otros mamíferos, insectos y ecosistemas biodiversos107. La carga y las consecuencias de esas infecciones —a saber, la gravedad de la enfermedad a nivel individual y los efectos de los brotes a nivel de la población— están determinadas tanto o más por factores sociales, económicos y políticos que por cualquier faceta de la ecología local o el cambio antropogénico mundial219.220.221.222. Se reconoce que el alivio de la pobreza y la mejora del acceso a la atención sanitaria son requisitos previos no sólo para mejorar la salud de la población, sino también para el desarrollo sostenible y el uso de los recursos naturales170.223.224. Por lo tanto, las soluciones ecológicas para gestionar el riesgo de enfermedad serán más eficaces en combinación con estrategias de salud pública "probadas y verdaderas", es decir, el fortalecimiento del sistema de salud225.226 y el fortalecimiento de capacidades para la preparación y respuesta ante brotes epidémicos227.
Problemas no resueltos para la gobernanza planetaria
A pesar de las conexiones entre la pérdida de biodiversidad y las enfermedades infecciosas emergentes, los esfuerzos globales sobre estos dos problemas han sido históricamente aislados. Las organizaciones multilaterales existentes (como la Organización Mundial de la Salud (OMS)) y los acuerdos (por ejemplo, el Reglamento Sanitario Internacional, en 2005) relacionados con la salud humana suelen centrarse en la preparación y respuesta ante brotes, prestando menos atención a la prevención o a los determinantes ambientales de la salud. Por el contrario, las organizaciones relacionadas con la conservación (por ejemplo, el Programa de las Naciones Unidas para el Medio Ambiente) y los acuerdos (por ejemplo, el Convenio sobre la Diversidad Biológica (CDB) en 1992) o la Convención sobre el Comercio Internacional de Especies Amenazadas de Fauna y Flora Silvestres (CITES) en 1973)) a menudo abordan la salud humana como una prioridad, pero por lo general se han tratado como algo accesorio de la arquitectura de seguridad sanitaria mundial.
La pandemia de COVID-19 puso en el punto de mira las enfermedades zoonóticas y sus impulsores, con cambios sustanciales asociados en la gobernanza mundial. La nueva asociación cuatripartita de las Naciones Unidas —una colaboración entre la OMS, la Organización de las Naciones Unidas para la Alimentación y la Agricultura, la Organización Mundial de Sanidad Animal y el Programa de las Naciones Unidas para el Medio Ambiente— ha establecido un Grupo de Expertos de Alto Nivel "Una Salud" y ha elaborado un Plan de Acción Conjunto "Una Salud". Este plan exige una mejor comprensión científica de la aparición de enfermedades; la integración de los sistemas de vigilancia de las enfermedades humanas y animales, los instrumentos de evaluación de riesgos y los factores desencadenantes de la acción; el desarrollo nacional de legislación basada en datos empíricos; y la financiación sostenible de los programas «Una sola salud». Mientras tanto, la secretaría del CDB ha comenzado a elaborar un plan de acción mundial sobre diversidad biológica y salud, y la secretaría de la CITES ha concertado un acuerdo de colaboración con la Organización Mundial de Sanidad Animal, con el fin de compartir conocimientos técnicos sobre el comercio de especies silvestres y sus riesgos para la salud humana.
Los factores que impulsan la aparición de enfermedades plantean un problema más complicado para la acción política mundial. La pérdida de biodiversidad, la deforestación, el cambio climático, la intensificación de la agricultura y el comercio de vida silvestre siguen aumentando, y algunos expertos han sugerido que revertir estas tendencias debería ser la máxima prioridad para los esfuerzos de prevención de pandemias98,99,101. Los tratados internacionales sobre el medio ambiente, como el CDB, la CITES y la Convención Marco de las Naciones Unidas sobre el Cambio Climático (en 1992), y los tratados conexos (en particular, el Acuerdo de París en 2015), han logrado avances sustanciales, pero incompletos, en sus respectivas áreas. El creciente costo de las enfermedades infecciosas emergentes ha fortalecido los argumentos para tomar medidas sobre los problemas ambientales98.228 , pero estos esfuerzos aún se enfrentan a una ardua batalla contra los abrumadores intereses financieros de las industrias extractivas. En particular, la demanda de los consumidores y los intereses corporativos en los EE. UU., Europa y China han sido a menudo una barrera sustancial para el éxito de estos tratados en el resto del mundo229.230.231.
En cualquier escenario plausible para el desarrollo económico mundial y el cambio ambiental, es poco probable que las tasas de contagio disminuyan en las próximas décadas: sin mejoras significativas tanto en la prevención de brotes como en la preparación, las epidemias y las pandemias seguirán aumentando en frecuencia, efectos y duración durante al menos una generación. Por lo tanto, los esfuerzos por fortalecer la arquitectura de la seguridad sanitaria mundial son un paso fundamental para prepararse para los efectos del cambio ambiental antropogénico en la salud. Si se aprueba, es probable que el Acuerdo sobre la Pandemia propuesto por la OMS reconozca el concepto de "Una sola salud" y podría establecer obligaciones para las partes en relación con la vigilancia, la fuerza laboral y las políticas destinadas a la prevención de enfermedades zoonóticas. Sin embargo, los programas de "Una sola salud" podrían costar entre 22.000 y 31.200 millones de dólares al año98,99, lo que representa un obstáculo para la adopción de medidas más sustantivas. También es poco probable que las estrategias multilaterales para abordar cuestiones como el comercio de especies silvestres estén bien desarrolladas en el texto finalizado, pero aún podrían lograrse mediante un anexo o protocolo del tratado232. A pesar de los enormes desafíos, el Acuerdo sobre Pandemias propuesto y las enmiendas al Reglamento Sanitario Internacional revisado adoptadas en 2024 representan importantes avances en la preparación y respuesta ante emergencias de salud pública: al mismo tiempo, podrían crear formas de financiar el desarrollo de capacidades, aumentar el cumplimiento y la diálogo cruzado entre los gobiernos nacionales y, lo que es más importante, garantizar que las vacunas y otras contramedidas se compartan de manera más equitativa durante futuras emergencias (Recuadro 3).
Resumen y orientaciones futuras
Los vínculos entre el cambio ambiental antropogénico, la pérdida de biodiversidad y la aparición de enfermedades están muy extendidos y, a menudo, son importantes determinantes de los resultados de salud humana y de la fauna silvestre. Sin embargo, saber que existen estos principios generales no es un sustituto del conocimiento específico del sistema. Los científicos deben comprender los principios ecológicos y evolutivos que se aplican caso por caso, y conectar la evidencia específica con diferentes objetivos de salud pública (como la prevención de pandemias, la reducción de la carga de enfermedades transmitidas por vectores o la gestión de riesgos relacionados con los virus de murciélagos). Los datos, las pruebas y las intervenciones pueden existir en un ciclo de retroalimentación dinámico, respaldado por colaboraciones entre la ciencia de la biodiversidad, la ecología de las enfermedades, la epidemiología y la salud pública. Paralelamente, es necesario subsanar varias lagunas importantes en la investigación científica y la síntesis.
En primer lugar, los ecólogos de enfermedades necesitan desarrollar una base de evidencia más diversa desde el punto de vista taxonómico, geográfico y ecológico en torno a las relaciones entre la biodiversidad y las enfermedades. La investigación sobre las enfermedades de la fauna silvestre está fuertemente sesgada hacia ciertas combinaciones de regiones, huéspedes y patógenos: por ejemplo, el virus de la rabia se estudia de manera desproporcionada, particularmente en murciélagos vampiros, en relación con otros virus de murciélagos en las Américas233. Estos sesgos están impulsados por lagunas de datos y las perpetúan (recuadro 2). De manera similar, los hábitats con algún grado de perturbación están mejor estudiados que las áreas prístinas, lo que dificulta la medición de los efectos de la perturbación en la dinámica de la enfermedad, en comparación con los diseños de muestreo equilibrados. La mayoría de los estudios también se limitan a eventos de muestreo único234; Los diseños de estudios longitudinales pueden documentar los efectos de los cambios antropogénicos a medida que se desarrollan, y demostrar la causalidad con un alto grado de confianza, particularmente si los investigadores también recopilan datos que capturan las respuestas de los organismos más allá de la infección (por ejemplo, biomarcadores de proteínas de estrés y función inmune235). Lo más importante es que los investigadores deben hacer un esfuerzo concertado para compartir datos espaciales sin procesar, reutilizables y a gran escala sobre los patrones de infección a nivel de organismo236, especialmente en los sistemas y partes del mundo con mayor escasez de datos.
En segundo lugar, se necesitan más investigaciones primarias sobre los efectos de las relaciones entre la biodiversidad y las enfermedades en los resultados de salud humana. La relación entre el cambio ecológico o la pérdida de biodiversidad y los resultados de las enfermedades a menudo es más débil en los seres humanos que en la vida silvestre54.237 , presumiblemente porque la dinámica de las enfermedades infecciosas en los seres humanos está mediada por una serie de otros factores sociales y estructurales. Una visión inclusiva de los sistemas socio-ecológicos, y evidencia comparativa adicional entre los sistemas de enfermedades humanas, podría desafiar los paradigmas basados principalmente en estudios de vida silvestre y estudios de casos bien conocidos107. La disponibilidad de datos sigue siendo el principal desafío: los datos de alta resolución sobre brotes de enfermedades infecciosas no están disponibles para los investigadores, especialmente a una escala espacial que se alinee con procesos ecológicos como la tala de bosques o el contacto entre el ganado y la vida silvestre. Los esfuerzos para compilar datos de la literatura, la colaboración con los ministerios de salud y la mejora de la vigilancia de brotes en comunidades remotas ayudarían a cerrar esta brecha.
Por último, las prioridades de investigación en ecología y ciencias de la biodiversidad deberían estar mejor alineadas con las prioridades de salud pública. A pesar de estar motivados por la prevención de pandemias, muchos estudios de ecología de enfermedades se centran en sistemas patógenos que representan una amenaza pandémica mínima (por ejemplo, el virus Nipah o la fiebre de Lassa), mientras que los sistemas con mayor riesgo (por ejemplo, virus de influenza o primates) están comparativamente poco estudiados. Del mismo modo, se necesita más investigación sobre la relación entre el cambio ambiental, la pérdida de biodiversidad y las enfermedades tropicales desatendidas (incluidas las zoonosis como la leptospirosis, la rabia y más de una docena de helmintiasis), que tienen una carga desproporcionada en las poblaciones más pobres del mundo238.239. Establecer relaciones con las autoridades nacionales de salud pública y las comunidades locales para identificar en colaboración las prioridades locales para el control de enfermedades y la investigación científica.240 ayudaría a descolonizar el proceso de investigación y suscitaría preguntas científicas. Los estudios sobre los impulsores de la aparición de enfermedades también superan sustancialmente en número a los estudios que muestran que estas tendencias pueden revertirse con las soluciones ecológicas propuestas: se necesita más investigación que mida los efectos de intervenciones como la restauración de los ecosistemas en los resultados de las enfermedades humanas y de la fauna silvestre209.210. Estos estudios ayudarán a argumentar ante los responsables de la toma de decisiones que las estrategias basadas en los ecosistemas son científicamente sólidas y tienen un alto retorno de la inversión.
Disponibilidad de datos
No se generaron datos originales durante el curso de este estudio, pero todos los datos necesarios para reproducir las cifras aquí se pueden encontrar en: https://github.com/viralemergence/pnpc.
Disponibilidad de códigos
Todo el código desarrollado en este estudio se puede encontrar en: https://github.com/viralemergence/pnpc. El análisis estadístico mínimo y todos los demás datos y análisis relacionados con el trazado se realizaron en R versión 4.3.2 (2023-10-31) (R Core Team 2023) utilizando el paquete rstanarm (R Core Team 2023; Goodrich et al. 2024). Todos los demás paquetes que usamos están referenciados en el archivo README del repositorio.
Referencias
Daszak, P., Cunningham, A. A. y Hyatt, A. D. Enfermedades infecciosas emergentes de la vida silvestre: amenazas para la biodiversidad y la salud humana. Ciencia 287, 443–449 (2000).
Wolfe, N. D., Dunavan, C. P. y Diamond, J. Orígenes de las principales enfermedades infecciosas humanas. Nature 447, 279–283 (2007).
Woolhouse, M., Scott, F., Hudson, Z., Howey, R. y Chase-Topping, M. Virus humanos: descubrimiento y emergencia. Phil. Trans. R. Soc. Lond. B 367, 2864–2871 (2012).
Meadows, A. J., Stephenson, N., Madhav, N. K. y Oppenheim, B. Las tendencias históricas demuestran un patrón de eventos de contagio cada vez más frecuentes y graves de virus zoonóticos de altas consecuencias. BMJ Glob. Salud 8, e012026 (2023).
Keesing, F. et al. Impactos de la biodiversidad en la aparición y transmisión de enfermedades infecciosas. Nature 468, 647–652 (2010).
Baker, R. E. et al. Enfermedades infecciosas en una era de cambio global. Nat. Rev. Microbiol. 20, 193–205 (2022).
Allen, T. y cols. Puntos críticos mundiales y correlatos de enfermedades zoonóticas emergentes. Nat. Commun. 8, 1124 (2017).
Lawler, O. K. y cols. La pandemia de COVID-19 está estrechamente relacionada con la pérdida de biodiversidad y la salud de los ecosistemas. Planeta Lancet. Salud 5, e840–e850 (2021).
Glidden, C. K. y cols. Impactos mediados por el hombre sobre la biodiversidad y las consecuencias para el contagio de enfermedades zoonóticas. Curr. Biol. 31, R1342–R1361 (2021).
Kock, R. A. y Cáceres-Escobar, H. Análisis de la situación sobre los roles y riesgos de la vida silvestre en la aparición de enfermedades infecciosas humanas (UICN, 2022).
Stephens, P. R. et al. La macroecología de las enfermedades infecciosas: una nueva perspectiva sobre los impulsores a escala global de la distribución y los impactos de los patógenos. Ecol. Lett. 19, 1159–1171 (2016).
Huang, S., Farrell, M. y Stephens, P. R. Macromanología de enfermedades infecciosas: diversidad y dinámica de parásitos en todo el mundo. Phil. Trans. R. Soc. Lond. B 376, 20200350 (2021).
Johnson, P. T. J., de Roode, J. C. y Fenton, A. Por qué la investigación de enfermedades infecciosas necesita ecología comunitaria. Ciencia 349, 1259504 (2015).
Carlson, C. J. et al. Un plan global de conservación de parásitos. Biol. Conserva. 250, 108596 (2020).
Rubio‐Godoy, M. y de León, G. P. Igualdad de derechos para los parásitos: Windsor 1995, revisado después de que la parasitología ecológica ha alcanzado la mayoría de edad. Biol. Conserva. https://doi.org/10.1016/j.biocon.2023.110174 (2023).
Weinstein, S. B. y Kuris, A. M. Orígenes independientes del parasitismo en Animalia. Biol. Lett. 12, 20160324 (2016).
Dolphin, K. & Quicke, D. L. J. Estimación de la riqueza global de especies de un taxón descrito de manera incompleta: un ejemplo usando avispas parasitoides (Hymenoptera: Braconidae). Biol. J. Linn. Soc. Lond. 73, 279–286 (2008).
Carlson, C. J., Dallas, T. A., Alexander, L. W., Phelan, A. L. y Phillips, A. J. ¿Qué se necesitaría para describir la diversidad global de parásitos? Proc. R. Soc. B 287, 20201841 (2020).
Dobson, A. P., Lafferty, K. D., Kuris, A. M., Hechinger, R. F. & Jetz, W. Homenaje a Linneo: ¿cuántos parásitos? ¿Cuántos hosts? Proc. Natl Acad. Sci. USA 105, 11482–11489 (2008).
Larsen, B. B., Miller, E. C., Rhodes, M. K. & Wiens, J. J. El cariño desmesurado se multiplicó y se redistribuyó: el número de especies en la Tierra y el nuevo pastel de la vida. Q. Rev. Biol. 92, 229–265 (2017).
Dallas, T. A. et al. Medición del apoyo a los patrones macroecológicos en parásitos helmintos. Glob. Ecol. Biogeogr. 27, 1437-1447 (2018).
Mollentze, N. y Streicker, D. G. El riesgo zoonótico viral es homogéneo entre los órdenes taxonómicos de huéspedes reservorios de mamíferos y aves. Proc. Natl Acad. Sci. USA. 117, 9423–9430 (2020).
Geoghegan, J. L., Duchêne, S. & Holmes, E. C. El análisis comparativo estima las frecuencias relativas de co-divergencia y transmisión entre especies dentro de las familias virales. PLoS Pathog. 13, E1006215 (2017).
Hoberg, E. P. y Brooks, D. R. Un mosaico macroevolutivo: cambio episódico de hospedador, colonización geográfica y diversificación en sistemas complejos huésped-parásito. J. Biogeogr. 35, 1533–1550 (2008).
Wallace, M. y cols. Dar sentido al viroma a la luz de la evolución y la ecología. Preimpresión en EcoEvoRxiv https://doi.org/10.32942/X21K8T (2024).
Kamiya, T., O'Dwyer, K., Nakagawa, S. y Poulin, R. La diversidad de huéspedes impulsa la diversidad de parásitos: perspectivas metaanalíticas sobre patrones y mecanismos causales. Ecografía 37, 689–697 (2014).
Poulin, R. y Jorge, F. La geografía del descubrimiento de parásitos a través de taxones y a lo largo del tiempo. Parasitología 146, 168–175 (2019).
Jorge, F. y Poulin, R. Mala coincidencia geográfica entre las distribuciones de la diversidad de huéspedes y el esfuerzo de descubrimiento de parásitos. Proc. Biol. Sci. 285, 20180072 (2018).
Quicke, D. L. J. Sabemos muy poco sobre la distribución de las avispas parasitoides como para sacar conclusiones sobre las tendencias latitudinales en la riqueza de especies, el tamaño corporal y la biología. PLoS ONE 7, e32101 (2012).
Rosenberg, R., Johansson, M. A., Powers, A. M. & Miller, B. R. La estrategia de búsqueda ha influido en la tasa de descubrimiento de virus humanos. Proc. Natl. Acad. Sci. USA 110, 13961–13964 (2013).
Gibb, R. y cols. Las estimaciones de la diversidad de virus de mamíferos son inestables debido a la aceleración de los esfuerzos de descubrimiento. Biol. Lett. 18 de 20210427 (2022).
Lu, L. y cols. Dinámica temporal, descubrimiento y aparición de virus de ARN transmisibles por humanos. Mol. Biol. Evol. 41, MSAD272 (2024).
Jones, K. E. y cols. Tendencias mundiales en enfermedades infecciosas emergentes. Nature 451, 990–993 (2008).
Carlson, C. J. et al. The Global Virome in One Network (VIRION): un atlas de asociaciones entre vertebrados y virus. mBio 13, e0298521 (2022).
Carroll, D. et al. El proyecto global virome. Ciencia 359, 872–874 (2018).
Wille, M., Geoghegan, J. L. y Holmes, E. C. ¿Con qué precisión podemos evaluar el riesgo zoonótico? PLoS Biol. 19, E3001135 (2021).
Olival, K. J. y cols. El huésped y los rasgos virales predicen el contagio zoonótico de los mamíferos. Nature 546, 646–650 (2017).
Albery, G. F. et al. Las especies de mamíferos adaptadas a las zonas urbanas tienen patógenos más conocidos. Nat. Ecol. Evol. 6, 794–801 (2022).
Zhou, P. y cols. Contracción del locus de IFN tipo I y expresión constitutiva inusual de IFN-α en murciélagos. Proc. Natl. Acad. Sci. USA 113, 2696–2701 (2016).
Irving, A. T., Ahn, M., Goh, G., Anderson, D. E. y Wang, L.-F. Lecciones de las defensas del huésped de los murciélagos, un reservorio viral único. Naturaleza 589, 363–370 (2021).
Brook, C. E., Rozins, C., Guth, S. & Boots, M. La inmunología del huésped reservorio y la historia de vida dan forma a la evolución de la virulencia en los virus zoonóticos. PLoS Biol. 21, E3002268 (2023).
Guth, S. et al. Los murciélagos albergan los virus zoonóticos más virulentos, pero no los más peligrosos. Proc. Natl Acad. Sci. USA 119, e2113628119 (2022).
Guth, S., Visher, E., Boots, M. & Brook, C. E. La distancia filogenética del huésped impulsa las tendencias en la virulencia y transmisibilidad del virus a través de la interfaz animal-humano. Phil. Trans. R. Soc. Lond. B 374, 20190296 (2019).
Walker, J. W., Han, B. A., Ott, I. M. y Drake, J. M. Transmisibilidad de zoonosis virales emergentes. PLoS ONE 13, e0206926 (2018).
Cincotta, R. P., Wisnewski, J. y Engelman, R. Población humana en los puntos calientes de biodiversidad. Nature 404, 990–992 (2000).
de Thoisy, B., Gräf, T., Mansur, D. S., Delfraro, A. & Dos Santos, C. N. D. El riesgo de emergencia del virus en América del Sur: un sutil equilibrio entre condiciones cada vez más favorables y un entorno protector. Annu. Rev. Virol. 11, 43–65 (2024).
Brierley, L., Vonhof, M. J., Olival, K. J., Daszak, P. & Jones, K. E. Cuantificación de los impulsores globales de los virus zoonóticos de murciélagos: una perspectiva basada en procesos. Am. Nat. 187, E53–E64 (2016).
Han, B. A. et al. Murciélagos huéspedes de filovirus no descubiertos. PLoS Negl. Trop. Dis. 10, E0004815 (2016).
Becker, D. J. et al. Optimización de modelos predictivos para priorizar el descubrimiento viral en reservorios zoonóticos. Lancet Microbe 3, e625–e637 (2022).
Schulz, J. E. et al. Evidencia serológica de la presencia de virus tipo Henipa y Filo en murciélagos de Trinidad. J. Infect. Dis. 221, S375–S382 (2020).
Hernández, L. H. A. et al. Primera evidencia genómica de un virus similar a la Henipa en Brasil. Virus 14, 2167 (2022).
Halsey, S. Desactiva el debate sobre el efecto de dilución. Nat. Ecol. Evol. 3, 145–146 (2019).
Halliday, F. W., Rohr, J. R. y Laine, A.-L. La pérdida de biodiversidad subyace al efecto de dilución de la biodiversidad. Ecol. Lett. 23, 1611-1622 (2020).
Mahon, M. B. et al. Un metaanálisis sobre los impulsores del cambio global y el riesgo de enfermedades infecciosas. Naturaleza 629, 830–836 (2024).
Huang, Z. Y. X., Yu, Y., VAN Langevelde, F. y DE Boer, W. F. ¿El efecto de dilución ocurre generalmente en enfermedades animales? Parasitología 144, 823–826 (2017).
Gallagher, S. J. et al. Manadas sanas pero más pequeñas: los depredadores reducen la transmisión de patógenos en un conjunto de anfibios. J. Anim. Ecol. 88, 1613-1624 (2019).
López, L. K. et al. Una manada sana pero agotada: los depredadores disminuyen las enfermedades y la densidad de las presas. Ecología 104, e4063 (2023).
Levi, T., Kilpatrick, A. M., Mangel, M. y Wilmers, C. C. Ciervos, depredadores y la aparición de la enfermedad de Lyme. Proc. Natl. Acad. Sci. USA 109, 10942–10947 (2012).
Johnson, P. T. J., Preston, D. L., Hoverman, J. T. y Richgels, K. L. D. La biodiversidad disminuye la enfermedad a través de cambios predecibles en la competencia de la comunidad anfitriona. Nature 494, 230–233 (2013).
Huang, Z. Y. X., VAN Langevelde, F., Estrada-Peña, A., Suzán, G. y DE Boer, W. F. La relación diversidad-enfermedad: evidencias y críticas al efecto de dilución. Parasitología 143, 1075–1086 (2016).
Allan, B. F., Keesing, F. y Ostfeld, R. S. Efecto de la fragmentación del bosque en el riesgo de la enfermedad de Lyme. Conservar. Biol. 17, 267–272 (2003).
Keesing, F. et al. Huéspedes como trampas ecológicas para el vector de la enfermedad de Lyme. Proc. Biol. Sci. 276, 3911–3919 (2009).
Gibb, R. y cols. La diversidad de hospedadores zoonóticos aumenta en los ecosistemas dominados por el hombre. Naturaleza 584, 398–402 (2020).
Ecke, F. y cols. Las fluctuaciones poblacionales y la sinantropía explican el riesgo de transmisión en las zoonosis transmitidas por roedores. Nat. Commun. 13, 7532 (2022).
Previtali, M. A. et al. Relación entre el ritmo de vida y las respuestas inmunitarias en roedores silvestres. Oikos 121, 1483-1492 (2012).
Albery, G. F. y Becker, D. J. Huéspedes de vida rápida y riesgo zoonótico. Tendencias Parasitol. 37, 117–129 (2021).
Plourde, B. T. y cols. ¿Son especiales los reservorios de enfermedades? Características taxonómicas y de historia de vida. PLoS ONE 12, e0180716 (2017).
Farrell, M. J., Stephens, P. R., Berrang-Ford, L., Gittleman, J. L. y Davies, T. J. El camino hacia la extinción del huésped puede conducir a la pérdida de parásitos generalistas. J. Anim. Ecol. 84, 978–984 (2015).
Esser, H. J., Herre, E. A., Kays, R., Liefting, Y. & Jansen, P. A. Coextinción local entre huésped y garrapata en fragmentos de bosque neotropical. Int. J. Parasitol. 49, 225–233 (2019).
Sitko, J. y Heneberg, P. Colapso sistémico de una red de trematodos huésped-parásito asociada con aves de humedales en Europa. Parasitol. Res. 119, 935–945 (2020).
Wood, C. L. et al. Una reconstrucción de la carga parasitaria revela un siglo de disminución de parásitos asociada al clima. Proc. Natl. Acad. Sci. USA 120, e2211903120 (2023).
Carlson, C. J. et al. La biodiversidad de parásitos se enfrenta a la extinción y la redistribución en un clima cambiante. Sci. Adv. 3, E1602422 (2017).
Neely, W. J. et al. La diversidad de helmintos asociados al huésped y la composición del microbioma contribuyen a las defensas antipatógenas en las ranas tropicales afectadas por la fragmentación del bosque. R. Soc. Open Sci. 11, 240530 (2024).
Johnson, P. T. J., Preston, D. L., Hoverman, J. T. & LaFonte, B. E. La diversidad de huéspedes y parásitos controla conjuntamente el riesgo de enfermedades en comunidades complejas. Proc. Natl. Acad. Sci. USA 110, 16916–16921 (2013).
Ezenwa, V. O. y Jolles, A. E. Efectos opuestos del tratamiento antihelmíntico sobre la infección microbiana a escala individual frente a la poblacional. Ciencia 347, 175–177 (2015).
Sweeny, A. R. et al. La perturbación experimental de la comunidad de parásitos revela asociaciones entre el virus Sin Nombre y los nematodos gastrointestinales en un huésped reservorio de roedores. Biol. Lett. 16 de 20200604 (2020).
Dougherty, E. R. et al. Paradigmas para la conservación de parásitos. Conservar. Biol. 30, 724–733 (2016).
Tompkins, D. M., Carver, S., Jones, M. E., Krkošek, M. & Skerratt, L. F. Enfermedades infecciosas emergentes de la vida silvestre: una perspectiva crítica. Tendencias Parasitol. 31, 149–159 (2015).
Sanderson, C. E. y Alexander, K. A. Aguas desconocidas: es probable que el cambio climático intensifique los brotes de enfermedades infecciosas que causan eventos de mortalidad masiva en mamíferos marinos. Glob. Chang. Biol. 26, 4284–4301 (2020).
Kock, R. A. y cols. Saigas al borde del abismo: análisis multidisciplinario de los factores que influyen en los eventos de mortalidad masiva. Sci. Adv. 4, EAAO2314 (2018).
Fereidouni, S. et al. Mortandad masiva de antílopes saiga, Kazajistán, 2015. Emerger. Infecta. Dis. 25, 1169–1176 (2019).
Pruvot, M. y cols. Brote de peste de pequeños rumiantes entre el saiga mongol y otros ungulados silvestres en peligro crítico de extinción, Mongolia, 2016-2017. Emerger. Infecta. Dis. 26, 51–62 (2020).
De Castro, F. y Bolker, B. Mecanismos de extinción inducida por enfermedades. Ecol. Lett. 8, 117–126 (2005).
Bonhoeffer, S., Lenski, R. E. y Ebert, D. La maldición del faraón: la evolución de la virulencia en patógenos con propágulos longevos. Proc. Biol. Sci. 263, 715–721 (1996).
Fisher, M. C. & Garner, T. W. J. Hongos quítridos y declives globales de anfibios. Nat. Rev. Microbiol. 18, 332–343 (2020).
Stegen, G. et al. Impulsores de la extirpación de salamandras mediada por Batrachochytrium salamandrivorans. Nature 544, 353–356 (2017).
Castro Monzón, F., Rödel, M.-O., Ruland, F., Parra-Olea, G. & Jeschke, J. M. Especies de anfibios hospedantes y rango de invasión de Batrachochytrium salamandrivorans. Ecosalud 19, 475–486 (2022).
Hoyt, J. R., Kilpatrick, A. M. y Langwig, K. E. Ecología e impactos del síndrome de la nariz blanca en los murciélagos. Nat. Rev. Microbiol. 19, 196–210 (2021).
Springborn, M. R., Weill, J. A., Lips, K. R., Ibáñez, R. & Ghosh, A. Los colapsos de anfibios aumentaron la incidencia de malaria en América Central. Medio Ambiente. Res. Lett. 17 de 104012 (2022).
Frank, E. G. Los impactos económicos de las alteraciones de los ecosistemas: costos de la sustitución del control biológico de plagas. Ciencia 385, eadg0344 (2024).
Xie, R. et al. El resurgimiento episódico del virus de la influenza aviar H5 altamente patógeno. Naturaleza 622, 810–817 (2023).
Muñoz, G. et al. Varamiento y mortalidad masiva en pingüinos de Humboldt (Spheniscus humboldti), asociados al brote de HPAIV H5N1 en Chile. Prev. Vet. Med. 227, 106206 (2024).
Nerpel, A. et al. SARS-ANI: un conjunto de datos global de acceso abierto de eventos de SARS-CoV-2 reportados en animales. Sci. Data 9, 438 (2022).
Fagre, A. C. y cols. Evaluar el riesgo de transmisión de patógenos de humanos a fauna silvestre para la conservación y la salud pública. Ecol. Lett. 25, 1534-1549 (2022).
Weary, T. E. et al. Los virus del resfriado común que circulan en los niños amenazan a los chimpancés salvajes a través de portadores adultos asintomáticos. Sci. Rep. 14, 10431 (2024).
Köndgen, S. et al. Los virus humanos pandémicos causan el declive de los grandes simios en peligro de extinción. Curr. Biol. 18, 260–264 (2008).
Hopkins, S. R. et al. Ensayo editorial: áreas protegidas y Una Salud. Parque. Recrear. 30, 6–13 (2024).
Bernstein, A. S. et al. Costos y beneficios de la prevención primaria de pandemias zoonóticas. Sci. Adv. 8, EAB4183 (2022).
Dobson, A. P. y cols. Ecología y economía para la prevención de pandemias. Ciencia 369, 379–381 (2020).
Vora, N. M. et al. ¿Quieres prevenir pandemias? Detenga los desbordamientos. Naturaleza 605, 419–422 (2022).
Vora, N. M. et al. Intervenciones para reducir el riesgo de propagación temprana de patógenos y propagación temprana de enfermedades para prevenir brotes, epidemias y pandemias. Emerger. Infecta. Dis. 29, 1–9 (2023).
Winkler, K., Fuchs, R., Rounsevell, M. y Herold, M. Los cambios globales en el uso de la tierra son cuatro veces mayores de lo que se estimaba anteriormente. Nat. Commun. 12, 2501 (2021).
IPBES. Resumen para los responsables de la formulación de políticas del Informe de Evaluación Mundial sobre la Diversidad Biológica y los Servicios de los Ecosistemas (IPBES, 2019).
Plowright, R. K. et al. Derrame inducido por el uso de la tierra: un llamado a la acción para salvaguardar la salud ambiental, animal y humana. Planeta Lancet. Salud 5, e237–e245 (2021).
Becker, D. J. et al. Macroinmunología: los impulsores y las consecuencias de los patrones espaciales en la defensa inmunitaria de la fauna silvestre. J. Anim. Ecol. 89, 972–995 (2020).
Eby, P. y cols. Propagación de patógenos impulsada por cambios rápidos en la ecología de los murciélagos. Naturaleza 613, 340–344 (2023).
Gibb, R. y cols. La huella antropogénica en las enfermedades infecciosas emergentes. Preimpresión en bioRxiv https://doi.org/10.1101/2024.05.22.24307684 (2024).
Eskew, E. A. et al. El desplazamiento del reservorio por un roedor invasor reduce el riesgo de propagación zoonótica del virus de Lassa. Nat. Commun. 15, 3589 (2024).
Skinner, E. B., Glidden, C. K., MacDonald, A. J. y Mordecai, E. A. La huella humana se asocia con cambios en los ensamblajes de las principales enfermedades transmitidas por vectores. Nat. Sostener. 6, 652–661 (2023).
Morand, S., McIntyre, K. M. y Baylis, M. Animales domesticados y enfermedades infecciosas humanas de origen zoonótico: el tiempo de domesticación importa. Infecta. Jineta. Evol. 24, 76–81 (2014).
Greenspoon, L. et al. La biomasa mundial de mamíferos silvestres. Proc. Natl. Acad. Sci. USA 120, e2204892120 (2023).
Johnson, C. K. y cols. Propiedades indirectas y pandémicas de virus zoonóticos con alta plasticidad del huésped. Sci. Rep. 5, 14830 (2015).
Jones, B. A. et al. Aparición de zoonosis vinculada a la intensificación agrícola y al cambio ambiental. Proc. Natl. Acad. Sci. USA 110, 8399–8404 (2013).
Hayek, M. N. La trampa de las enfermedades infecciosas de la ganadería. Sci. Adv. 8, EADD6681 (2022).
Jori, F., Hernandez-Jover, M., Magouras, I., Dürr, S. & Brookes, V. J. Interacciones entre la vida silvestre y el ganado en los sistemas de producción animal: ¿cuáles son las implicaciones de bioseguridad y salud? Frente Animal. 11, 8–19 (2021).
Mora, C. et al. Más de la mitad de las enfermedades patógenas humanas conocidas pueden verse agravadas por el cambio climático. Nat. Clim. Cambio 12, 869–875 (2022).
Mardoqueo, E. A. y cols. Biología térmica de las enfermedades transmitidas por mosquitos. Ecol. Lett. 22, 1690-1708 (2019).
Carlson, C. J., Carleton, T. A., Odoulami, R. C. y Trisos, C. H. La huella histórica y el impacto futuro del cambio climático en la malaria infantil en África. Preimpresión en bioRxiv https://doi.org/10.1101/2023.07.16.23292713 (2023).
Childs, M. L., Lyberger, K., Harris, M., Burke, M. y Mordecai, E. A. El calentamiento climático está expandiendo la carga del dengue en las Américas y Asia. Preimpresión en medRxiv https://doi.org/10.1101/2024.01.08.24301015 (2024).
Carlson, C. J., Bannon, E., Mendenhall, E., Newfield, T. & Bansal, S. Cambios rápidos en el rango de distribución de los mosquitos Anopheles africanos durante el último siglo. Biol. Lett. 19 de 20220365 (2023).
Kraemer, M. U. G. et al. Propagación pasada y futura de los vectores de arbovirus Aedes aegypti y Aedes albopictus. Nat. Microbiol. 4, 854–863 (2019).
Eisen, R. J. y Eisen, L. Evaluación de la asociación entre el calentamiento climático y la propagación y proliferación de Ixodes scapularis en los estados del norte del este de los Estados Unidos. Garrapatas transmitidas por garrapatas Dis. 15 de 102286 (2024).
McCoy, K. D. et al. Cambio climático en el Ártico: prueba de la expansión hacia los polos de las garrapatas y las enfermedades transmitidas por garrapatas. Glob. Cambiar Biol. 29, 1729-1740 (2023).
VanWormer, E. et al. La aparición viral en mamíferos marinos en el Pacífico Norte puede estar relacionada con la reducción del hielo marino del Ártico. Sci. Rep. 9, 15569 (2019).
Morales-Castilla, I. et al. Predicción de la compartición de parásitos en el marco del cambio climático. Phil. Trans. R. Soc. Lond. B 376, 20200360 (2021).
Carlson, C. J. et al. El cambio climático aumenta el riesgo de transmisión viral entre especies. Naturaleza 607, 555–562 (2022).
Trisos, C. H., Merow, C. y Pigot, A. L. El momento proyectado de la interrupción ecológica abrupta del cambio climático. Nature 580, 496–501 (2020).
Pigot, A. L., Merow, C., Wilson, A. & Trisos, C. H. Expansión abrupta de los riesgos del cambio climático para las especies a nivel mundial. Nat. Ecol. Evol. 7, 1060–1071 (2023).
Worobey, M. et al. El mercado mayorista de mariscos de Huanan, en Wuhan, fue el epicentro inicial de la pandemia de COVID-19. Ciencia 377, 951–959 (2022).
Guan, Y. et al. Aislamiento y caracterización de virus relacionados con el coronavirus SARS a partir de animales en el sur de China. Ciencia 302, 276–278 (2003).
Wang, M. et al. Infección por SARS-CoV en un restaurante de civeta de palma. Emerger. Infecta. Dis. 11, 1860-1865 (2005).
Xiao, K. y cols. Aislamiento del coronavirus relacionado con el SARS-CoV-2 de pangolines malayos. Naturaleza 583, 286–289 (2020).
Hughes, L. J., Morton, O., Scheffers, B. R. y Edwards, D. P. Los impulsores ecológicos y las consecuencias del comercio de vida silvestre. Biol. Rev. Camb. Phil. Soc. 98, 775–791 (2023).
Huong, N. Q. et al. Las pruebas de coronavirus indican aumentos en el riesgo de transmisión a lo largo de las cadenas de suministro de vida silvestre para el consumo humano en Viet Nam, 2013-2014. PLoS ONE 15, e0237129 (2020).
Anthony, S. J. et al. Patrones globales en la diversidad del coronavirus. Virus Evol. 3, VEX012 (2017).
Él, W.-T. et al. La caracterización de los animales de caza en China revela un espectro de patógenos emergentes. Celda 185, 1117–1129.e8 (2022).
Brook, C. E. et al. Tendencias poblacionales de dos murciélagos frugívoros malgaches. Biol. Conserva. 234, 165–171 (2019).
Ripple, W. J. et al. La caza de carne de animales silvestres y el riesgo de extinción de los mamíferos del mundo. R. Soc. Abierto. Sci. 3, 160498 (2016).
Roy, H. E. et al. (eds) Informe de evaluación temática sobre especies exóticas invasoras y su control (Secretaría de la IPBES, 2023).
Bryant, J. E., Holmes, E. C. y Barrett, A. D. T. Fuera de África: una perspectiva molecular sobre la introducción del virus de la fiebre amarilla en las Américas. PLoS Pathog. 3, E75 (2007).
Mnzava, A., Monroe, A. C. y Okumu, F. Anopheles stephensi en África requiere una respuesta más integrada. Malar. J. 21, 156 (2022).
Ryan, S. J. et al. Mapeo de los límites térmicos actuales y futuros para la idoneidad para la transmisión de la malaria por el mosquito invasor Anopheles stephensi. Malar. J. 22, 104 (2023).
Rohr, J. R. y cols. Una innovación en salud planetaria para los desafíos de las enfermedades, la alimentación y el agua en África. Naturaleza 619, 782–787 (2023).
Weets, C. M. y Katz, R. Enfoques globales para abordar la resistencia a los antimicrobianos: un análisis exhaustivo de las políticas de agua, saneamiento e higiene. BMJ Glob. Salud 9, e013855 (2024).
Bürgmann, H. et al. Agua y saneamiento: un frente de batalla esencial en la guerra contra la resistencia a los antimicrobianos. FEMS Microbiol. Ecol. 94, https://doi.org/10.1093/femsec/fiy101 (2018).
Orozovic, G., Orozovic, K., Lennerstrand, J. y Olsen, B. Detección de mutaciones de resistencia a los antivirales oseltamivir y zanamivir en los virus de la influenza aviar A aislados de aves silvestres. PLoS ONE 6, e16028 (2011).
Rosi, E. J., Fick, J. B. y Han, B. A. ¿Están los reservorios de enfermedades animales en riesgo de exposición humana a antivirales? Environ. Sci. Technol. Lett. 10, 439–445 (2023).
Ostfeld, R. S. y Keesing, F. Biodiversidad y riesgo de enfermedad: el caso de la enfermedad de Lyme. Conservar. Biol. 14, 722–728 (2000).
Couper, L. I., MacDonald, A. J. y Mordecai, E. A. Impacto del cambio climático anterior y proyectado en la incidencia de la enfermedad de Lyme en los Estados Unidos. Glob. Cambiar Biol. 27, 738–754 (2021).
Plowright, R. K. et al. Habituación urbana, conectividad ecológica y amortiguación de epidemias: la aparición del virus Hendra a partir de zorros voladores (Pteropus spp.). Proc. Biol. Sci. 278, 3703–3712 (2011).
Becker, D. J., Eby, P., Madden, W., Peel, A. J. & Plowright, R. K. Las condiciones ecológicas predicen la intensidad de la excreción del virus Hendra en el espacio y el tiempo a partir de los huéspedes reservorios de murciélagos. Ecol. Lett. 26, 23–36 (2023).
Baranowski, K., Faust, C. L., Eby, P. y Bharti, N. Cuantificación de los impactos de los incendios forestales australianos en los bosques nativos y los zorros voladores de cabeza gris. Glob. Ecol. Conserv. 27, E01566 (2021).
Mo, M. y cols. Estimación de la mortalidad de zorros voladores asociada con abandonos de cachorros y eventos de calor extremo durante el verano austral de 2019-20. Pac. Conserv. Biol. 28, 124–139 (2021).
Plaza, P. I., Gamarra-Toledo, V., Euguí, J. R. y Lambertucci, S. A. Cambios recientes en los patrones de infección de mamíferos por el virus de la influenza aviar A(H5N1) altamente patógena en todo el mundo. Emerger. Infecta. Dis. 30, 444–452 (2024).
Guinat, C. et al. La filodinámica bayesiana revela la dinámica de transmisión del virus de la influenza aviar A(H7N9) en la interfaz del mercado humano-aves vivas en China. Proc. Natl Acad. Sci. USA 120, e2215610120 (2023).
Offeddu, V., Cowling, B. J. & Peiris, J. S. M. Intervenciones en mercados de aves de corral vivas para el control de la gripe aviar: una revisión sistemática. Una Salud 2, 55–64 (2016).
Yin, S. y cols. La pérdida de hábitat exacerba la propagación de patógenos: un modelo basado en agentes de la infección por gripe aviar en aves acuáticas migratorias. PLoS Comput. Biol. 18, E1009577 (2022).
Vandegrift, K. J., Sokolow, S. H., Daszak, P. y Kilpatrick, A. M. Ecología de los virus de la gripe aviar en un mundo cambiante. Ann. NY Acad. Sci. 1195, 113–128 (2010).
Prosser, D. J., Teitelbaum, C. S., Yin, S., Hill, N. J. & Xiao, X. Impactos del cambio climático en la migración de aves y la influenza aviar altamente patógena. Nat. Microbiol. 8, 2223–2225 (2023).
Crits-Christoph, A. et al. Rastreo genético de fauna silvestre y virus en el epicentro de la pandemia de COVID-19. Celda 187, 5468–5482.e11 (2024).
Pekar, J. E. et al. Epidemiología molecular de múltiples orígenes zoonóticos del SARS-CoV-2. Ciencia 377, 960–966 (2022).
Cui, J., Li, F. y Shi, Z.-L. Origen y evolución de los coronavirus patógenos. Nat. Rev. Microbiol. 17, 181–192 (2019).
Lednicky, J. A. et al. Infecciones independientes de deltacoronavirus porcino entre niños haitianos. Naturaleza 600, 133–137 (2021).
Vlasova, A. N. et al. Nuevo coronavirus canino aislado de un paciente hospitalizado con neumonía en el este de Malasia. Clin. Infecta. Dis. 74, 446–454 (2022).
Rulli, M. C., D'Odorico, P., Galli, N. y Hayman, D. T. S. El cambio en el uso de la tierra y la revolución ganadera aumentan el riesgo de transmisión zoonótica del coronavirus a partir de murciélagos rinófidos. Nat. Food 2, 409–416 (2021).
Beyer, R. M., Manica, A. & Mora, C. Los cambios en la diversidad global de murciélagos sugieren un posible papel del cambio climático en la aparición del SARS-CoV-1 y el SARS-CoV-2. Ciencia Total. Medio ambiente. 767, 145413 (2021).
Warmuth, V. M., Metzler, D. y Zamora-Gutiérrez, V. La perturbación humana aumenta la prevalencia del coronavirus en los murciélagos. Sci. Adv. 9, EADD0688 (2023).
Meyer, M. y cols. El ensamblaje de especies de murciélagos predice la prevalencia del coronavirus. Nat. Commun. 15, 2887 (2024).
Busch, J. y Engelmann, J. Rentabilidad de la reducción de las emisiones de la deforestación tropical, 2016-2050. Medio Ambiente. Res. Lett. 13, 015001 (2017).
Jones, I. J. y cols. Mejorar la atención de la salud rural reduce la tala ilegal y conserva el carbono en un bosque tropical. Proc. Natl. Acad. Sci. USA 117, 28515–28524 (2020).
Rockström, J. et al. Los bienes comunes planetarios: un nuevo paradigma para salvaguardar los sistemas reguladores de la Tierra en el antropoceno. Proc. Natl. Acad. Sci. USA 121, e2301531121 (2024).
Kashwan, P., Biermann, F., Gupta, A. y Okereke, C. Justicia planetaria: priorizar a los pobres en la gobernanza del sistema terrestre. 6, 100075 (2020).
Albery, G. F. et al. La ciencia de la red huésped-virus. Nat. Microbiol. 6, 1483-1492 (2021).
Tseng, K. K. y cols. Las características genómicas virales predicen los huéspedes reservorios de ortopoxvirus. Preimpresión en bioRxiv https://doi.org/10.1101/2023.10.26.564211 (2023).
Fischhoff, I. R., Castellanos, A. A., Rodrigues, J. P. G. L. M., Varsani, A. & Han, B. A. Predicción de la capacidad zoonótica de los mamíferos para transmitir el SARS-CoV-2. Proc. R. Soc. B 288, 20211651 (2021).
Betke, B. A., Gottdenker, N. L., Meyers, L. A. & Becker, D. J. Características ecológicas y evolutivas de la capacidad antropogénica de descanso en murciélagos del mundo. iScience 27, 110369 (2024).
Pruvot, M. y cols. WildHealthNet: apoya el desarrollo de redes sostenibles de vigilancia de la salud de la fauna silvestre en el sudeste asiático. Ciencia Total. Medio ambiente. 863, 160748 (2023).
Stevens, T. et al. Un estándar mínimo de datos para los estudios de enfermedades de la fauna silvestre. Preimpresión en EcoEvoRxiv https://doi.org/10.32942/x2tw4j (2024).
Richards, B. J., Miller, K. J. y White, C. L. WHISPers—Proporcionar conciencia situacional de las amenazas de enfermedades de la vida silvestre a la nación—Una hoja informativa para la comunidad de biovigilancia (USGS, 2022).
Geoghegan, J. L. et al. Muestreo virológico de fauna silvestre inaccesible con drones. Virus 10, 300 (2018).
Sievers, B. L. et al. Mercados inteligentes: aprovechar el potencial de las nuevas tecnologías para la vigilancia de enfermedades infecciosas endémicas y emergentes en los mercados alimentarios tradicionales. J. Virol. 98, E0168323 (2024).
Wägele, J. W. et al. Hacia una estación multisensor para el seguimiento automatizado de la biodiversidad. Básico. Appl. Ecol. 59, 105–138 (2022).
Ärje, J. et al. Identificación automática de invertebrados basada en imágenes y estimación de biomasa. Métodos Ecol. Evol. 11, 922–931 (2020).
Baird, D. J. y Hajibabaei, M. Biomonitoring 2.0: un nuevo paradigma en la evaluación de ecosistemas hecho posible por la secuenciación de ADN de próxima generación. Mol. Ecol. 21, 2039–2044 (2012).
Heberling, J. M., Miller, J. T., Noesgaard, D., Weingart, S. B. & Schigel, D. La integración de datos permite la síntesis de la biodiversidad global. Proc. Natl Acad. Sci. USA 118, e2018093118 (2021).
Li, S. L. y cols. Mapeo de la idoneidad ambiental de los mosquitos Haemagogus y Sabethes spp. para comprender el riesgo de transmisión selvática del virus de la fiebre amarilla en Brasil. PLoS Negl. Trop. Dis. 16, E0010019 (2022).
Gippet, J. M. W., Bates, O. K., Moulin, J. y Bertelsmeier, C. El riesgo global de que surjan enfermedades infecciosas por la invasión de caracoles terrestres gigantes y el comercio de mascotas. Parásito. Vectores 16, 363 (2023).
Simons, D., Attfield, L. A., Jones, K. E., Watson-Jones, D. & Kock, R. Estudios de captura de roedores como una fuente de información pasada por alto para comprender el derrame zoonótico endémico y novedoso. PLoS Negl. Trop. Dis. 17, E0010772 (2023).
Redding, D. W., Gibb, R. y Jones, K. E. Los impactos ecológicos del cambio climático transformarán las prioridades de salud pública para las enfermedades zoonóticas y transmitidas por vectores. Preimpresión en bioRxiv https://doi.org/10.1101/2024.02.09.24302575 (2024).
García-Peña, G. E. et al. Cambio de uso de la tierra y enfermedades transmitidas por roedores: peligros en las vías socioeconómicas compartidas. Phil. Trans. R. Soc. Lond. B 376, 20200362 (2021).
Astorga, F. et al. Los datos sobre biodiversidad respaldan la investigación sobre enfermedades infecciosas humanas: tendencias, desafíos y oportunidades mundiales. Una Salud 16 de 100484 (2023).
Edmunds, S. C. et al. Publicación de datos para apoyar la lucha contra las enfermedades transmitidas por vectores humanos. Gigascience 11, giac114 (2022).
Shimabukuro, P. et al. Tendiendo puentes entre la biodiversidad y la salud: iniciativa del Fondo Mundial de Información sobre Biodiversidad sobre datos abiertos sobre vectores de enfermedades humanas. GigaByte 2024, gigabyte117 (2024).
Južnič-Zonta, Ž. et al. Mosquito Alert: leverage citizen science to create a GBIF mosquito occurrence dataset. GigaByte 2022, gigabyte54 (2022).
Carney, R. M. et al. Integración de plataformas globales de ciencia ciudadana para permitir la vigilancia de próxima generación de mosquitos invasores y vectores. Insectos 13, 675 (2022).
Rund, S. S. C., Moise, I. K., Beier, J. C. & Martinez, M. E. Rescatando tesoros de datos ecológicos ocultos para hacer frente a las enfermedades emergentes transmitidas por mosquitos. J. Am. Mosq. Control. Asoc. 35, 75–83 (2019).
DiEuliis, D., Johnson, K. R., Morse, S. S. & Schindel, D. E. Las colecciones de especímenes deberían tener un papel mucho más importante en la investigación y respuesta a las enfermedades infecciosas. Proc. Natl. Acad. Sci. USA 113, 4–7 (2016).
Thompson, C. W. et al. ¡Conserve un espécimen de cupón! La necesidad crítica de integrar las colecciones de historia natural en los estudios de enfermedades infecciosas. mBio 12, e02698-20 (2021).
Colella, J. P. et al. Aprovechar los biorepositorios de historia natural como una red global y descentralizada de vigilancia de patógenos. PLoS Pathog. 17, E1009583 (2021).
Wood, C. L. y Vanhove, M. P. M. ¿Es el mundo más gusano de lo que solía ser? Nunca lo sabremos sin colecciones de historia natural. J. Anim. Ecol. 92, 250–262 (2023).
Bell, K. C., Carlson, C. J. & Phillips, A. J. Colecciones de parásitos: recursos pasados por alto para la investigación integradora y la conservación. Tendencias Parasitol. 34, 637–639 (2018).
Hämmerle, M. et al. Detección de virus de ADN en especímenes del museo de grandes simios. Sci. Rep. 14, 29806 (2024).
Speer, K. A. y cols. Un estudio comparativo de los rendimientos de ARN de especímenes de museo, que incluye un protocolo optimizado para extraer ARN de especímenes fijados en formol. Frente. Ecol. Evol. 10, 953131 (2022).
Martínez, S. et al. Vivir de manera segura con murciélagos: lecciones para desarrollar y compartir un recurso educativo global de "Una Salud". Glob. Ciencias de la Salud Pract. 10, E2200106 (2022).
Ammán, B. R. y otros. Resurgimiento del virus de la enfermedad de Marburgo en la población de murciélagos de la mina Kitaka después de los intentos de exterminio, Uganda. Emerger. Infecta. Dis. 20, 1761-1764 (2014).
Viana, M. et al. Efectos del sacrificio de murciélagos vampiros en la propagación espacial y el contagio del virus de la rabia. Sci. Adv. 9, eadd7437 (2023).
Jenkins, H. E. et al. Efectos del sacrificio en las asociaciones espaciales de infecciones por Mycobacterium bovis en tejones y ganado. J. Appl. Ecol. 44, 897–908 (2007).
Hopkins, S. R. et al. Evidencia, brechas y diversidad entre las posibles soluciones beneficiosas para la conservación y el control de enfermedades infecciosas humanas. Planeta Lancet. Salud 6, e694–e705 (2022).
Reaser, J. K., Witt, A., Tabor, G. M., Hudson, P. J. y Plowright, R. K. Contramedidas ecológicas para prevenir brotes de enfermedades zoonóticas: cuando la restauración ecológica es un imperativo para la salud humana. Restor. Ecol. 29, E13357 (2021).
Prist, P. R. et al. Promoción de paisajes con bajo riesgo de enfermedades zoonóticas mediante la restauración forestal: necesidad de directrices exhaustivas. J. Appl. Ecol. 60, 1510-1521 (2023).
Gallagher, M. R. et al. ¿Puede la restauración de los ecosistemas dependientes del fuego reducir la prevalencia de garrapatas y enfermedades transmitidas por garrapatas en el este de los Estados Unidos? Ecol. Appl. 32, E2637 (2022).
Pattanayak, S. K., Kramer, R. A. y Vincent, J. R. Cambio ecosistémico y salud humana: economía y política de implementación. Phil. Trans. R. Soc. Lond. B 372, 20160130 (2017).
Hopkins, S. R. et al. Cómo identificar intervenciones beneficiosas para todos que beneficien la salud humana y la conservación. Nat. Sostener. 4, 298–304 (2020).
Trisos, C. H. et al. La pesca con mosquiteros ejemplifica el conflicto entre los Objetivos de Desarrollo Sostenible. Nat. Sostener. 2, 5–7 (2019).
Bonwitt, J. y cols. Consecuencias no deseadas de la "prohibición de la carne de animales silvestres" en África Occidental durante la epidemia de enfermedad por el virus del Ébola de 2013-2016. Soc. Sci. Med. 200, 166–173 (2018).
Li, Y. y cols. El cierre de los mercados de aves vivas conduce a la propagación de la gripe H7N9 en China. PLoS ONE 13, e0208884 (2018).
Quammen, D. Spillover: Infecciones animales y la próxima pandemia humana (W. W. Norton, 2012).
Osofsky, S. A., Lieberman, S., Walzer, C., Lee, H. L. y Neme, L. A. Una forma inmediata de reducir el riesgo de pandemia: (no) aprovechar la fruta madura (murciélago). Planeta Lancet. Salud 7, e518–e526 (2023).
Dzingirai, V. et al. Factores estructurales de la vulnerabilidad a las enfermedades zoonóticas en África. Phil. Trans. R. Soc. Lond. B 372, 20160169 (2017).
Magalhães, A. R. et al. El riesgo de enfermedades tropicales desatendidas se correlaciona con la pobreza y la destrucción temprana de los ecosistemas. Inf. Dis. Pobreza 12, 32 (2023).
Sokolow, S. H. et al. Factores ecológicos y socioeconómicos asociados a la carga humana de patógenos mediados por el medio ambiente: un análisis global. Planeta Lancet. Salud 6, e870–e879 (2022).
Farmer, P. Desigualdades sociales y enfermedades infecciosas emergentes. Emerger. Infecta. Dis. 2, 259–269 (1996).
Fiorella, K. J. et al. La salud humana altera la sostenibilidad de las prácticas pesqueras en el este de África. Proc. Natl. Acad. Sci. USA 114, 4171–4176 (2017).
Bonds, M. H., Keenan, D. C., Rohani, P. & Sachs, J. D. Trampa de pobreza formada por la ecología de las enfermedades infecciosas. Proc. Biol. Sci. 277, 1185–1192 (2010).
Worsley-Tonks, K. E. L. et al. Fortalecimiento de la seguridad sanitaria mundial mediante la mejora de la vigilancia de las enfermedades en las zonas rurales remotas de los países de ingresos bajos y medianos. Lancet Glob. Salud 10, e579–e584 (2022).
Wenham, C. et al. La seguridad sanitaria mundial y la cobertura sanitaria universal: de un matrimonio de conveniencia a una asociación estratégica y eficaz. BMJ Glob. Salud 4, e001145 (2019).
Moore, M. y cols. Componentes básicos de la respuesta a los brotes de enfermedades infecciosas. SSM - Sistema de Salud. 3, 100030 (2024).
Pike, J., Bogich, T., Elwood, S., Finnoff, D. C. y Daszak, P. Optimización económica de una estrategia global para hacer frente a la amenaza pandémica. Proc. Natl. Acad. Sci. USA 111, 18519–18523 (2014).
Galaz, V. et al. Influencia financiera en los riesgos globales de enfermedades zoonóticas emergentes y reemergentes: un análisis integrador. Planeta Lancet. Salud 7, e951–e962 (2023).
Hoffman, S. J. y cols. La mayoría de los tratados internacionales no han producido los efectos previstos. Proc. Natl. Acad. Sci. USA 119, e2122854119 (2022).
Liew, J. H. y cols. La desigualdad socioeconómica internacional impulsa los patrones comerciales en el mercado mundial de vida silvestre. Sci. Adv. 7, EABF7679 (2021).
Gallo-Cajiao, E. et al. Gobernanza mundial para la prevención de pandemias y el comercio de vida silvestre. Planeta Lancet. Salud 7, e336–e345 (2023).
Heckley, A. M., Lock, L. R. y Becker, D. J. Un metaanálisis que explora las asociaciones entre la degradación del hábitat y la prevalencia y seroprevalencia del virus neotropical de los murciélagos. Ecografía 2024, e07041 (2024).
Cohen, L. E., Fagre, A. C., Chen, B., Carlson, C. J. & Becker, D. J. Muestreo y vigilancia del coronavirus en murciélagos desde 1996 hasta 2019: una revisión sistemática y metaanálisis. Nat. Microbiol. 8, 1176–1186 (2023).
Vicente-Santos, A. et al. La proteómica sérica revela un fenotipo inmune tolerante a través de múltiples taxones de patógenos en murciélagos vampiros salvajes. Frente. Inmunol. 14 de 1281732 (2023).
Albery, G. F., Sweeny, A. R., Becker, D. J. & Bansal, S. Los patrones espaciales a gran escala de las enfermedades de la fauna silvestre son comunes y poco estudiados. Funct. Ecol. 36, 214–225 (2022).
Civitello, D. J. et al. La biodiversidad inhibe los parásitos: amplia evidencia del efecto de dilución. Proc. Natl. Acad. Sci. USA 112, 8667–8671 (2015).
Di Bari, C. et al. La carga mundial de las enfermedades zoonóticas desatendidas: estado actual de la evidencia. Una Salud 17, 100595 (2023).
Benavides, J. A. y cols. Definir nuevas vías para el manejo de la actual emergencia de la rabia de murciélagos en América Latina. Virus 12, 1002 (2020).
Standley, C. J., Fogarty, A. S., Miller, L. N. y Sorrell, E. M. Evaluaciones de los sistemas de salud para el fortalecimiento sostenible de la capacidad de control de las enfermedades zoonóticas prioritarias dentro de los países y entre ellos. Gestión de riesgos. Saludc. Política 16, 2497–2504 (2023).
Ceballos, G. et al. Pérdidas aceleradas de especies modernas inducidas por el hombre: entrando en la sexta extinción masiva. Sci. Adv. 1, E1400253 (2015).
Van Kerkhove, M. D., Ryan, M. J. y Ghebreyesus, T. A. Preparación para la 'enfermedad X'. Ciencia 374, 377 (2021).
Morse, S. S. et al. Predicción y prevención de la próxima zoonosis pandémica. Lancet 380, 1956-1965 (2012).
Wolfe, N. D., Daszak, P., Kilpatrick, A. M. & Burke, D. S. Caza de carne de animales silvestres, deforestación y predicción de la aparición de zoonosis. Emerger. Infecta. Dis. 11, 1822-1827 (2005).
Wolfe, N. D. et al. Infecciones por retrovirus de simios adquiridas de forma natural en cazadores centroafricanos. Lancet 363, 932–937 (2004).
Dai, L. y cols. Un diseño universal de las vacunas contra el betacoronavirus contra la COVID-19, el MERS y el SARS. Celda 182, 722–733.e11 (2020).
Nachbagauer, R. et al. Un enfoque quimérico de vacuna universal contra el virus de la influenza a base de hemaglutinina induce una inmunidad amplia y duradera en un ensayo de fase I aleatorizado y controlado con placebo. Nat. Med. 27, 106–114 (2021).
Gibb, R. y cols. Proliferación, reconciliación y síntesis de datos en ecología viral. Biociencia 71, 1148–1156 (2021).
Stephens, P. R. et al. Base de datos mundial de parásitos de mamíferos versión 2.0. Ecología 98, 1476 (2017).
Bensch, S., Hellgren, O. & Pérez-Tris, J. MalAvi: una base de datos pública de parásitos de la malaria y hemoporidios relacionados en huéspedes aviares basados en linajes de citocromo b mitocondrial. Mol. Ecol. Resour. 9, 1353–1358 (2009).
Luis, A. D. et al. Comparación de murciélagos y roedores como reservorios de virus zoonóticos: ¿son especiales los murciélagos? Proc. Biol. Sci. 280, 20122753 (2013).
Heckley, A. M. y Becker, D. J. Ectoparasitismo de murciélagos tropicales en bosques continuos versus fragmentados: un análisis de brechas y metaanálisis preliminar. Ecol. Evol. 13, E9784 (2023).
Murray, M. H. et al. ¿La ciudad está más enferma? Un meta-análisis de la salud de la fauna silvestre y la urbanización. Frente. Ecol. Alrededores. 17, 575–583 (2019).
Fanelli, D. Los resultados negativos están desapareciendo de la mayoría de las disciplinas y países. Cienciometría 90, 891–904 (2012).
Winands-Kalkuhl, S. y Holm-Müller, K. ¿Bilateral vs. multilateral? Sobre la economía y la política de un mecanismo mundial para el uso de los recursos genéticos. J. Nat. Resour. Res. 7, 305–322 (2015).
Deplazes-Zemp, A. et al. El protocolo de Nagoya podría ser contraproducente para el Sur Global. Nat. Ecol. Evol. 2, 917–919 (2018).
Lajaunie, C. & Morand, S. Protocolo de Nagoya y enfermedades infecciosas: ¿obstáculo u oportunidad? Frente. Público. Salud 8, 238 (2020).
Laird, S. et al. Replantearse la expansión del acceso y la participación en los beneficios. Ciencia 367, 1200–1202 (2020).
Richter, C. D. La Oficina Europea de Patentes concede una controvertida patente que protege el virus: lecciones del brote de coronavirus del síndrome respiratorio de Oriente Medio. Nat. Biotechnol. 39, 287–290 (2021).
Moore, S., Hill, E. M., Dyson, L., Tildesley, M. J. & Keeling, M. J. Modelado retrospectivo de los efectos del aumento del intercambio mundial de vacunas en la pandemia de COVID-19. Nat. Med. 28, 2416–2423 (2022).
Watson, O. J. y cols. Impacto global del primer año de vacunación contra la COVID-19: un estudio de modelización matemática. Lancet infect. Dis. 22, 1293–1302 (2022).
Sedyaningsih, E. R., Isfandari, S., Soendoro, T. y Supari, S. F. Hacia la confianza mutua, la transparencia y la equidad en el mecanismo de intercambio de virus: el caso de gripe aviar de Indonesia. Ann. Acad. Med. Singap. 37, 482–488 (2008).
Carlson, C. J. et al. Salvar vidas en la próxima pandemia: garantice la equidad en las vacunas ahora. Naturaleza 626, 952–953 (2024).
Carlson, C. et al. Equidad de datos de ingeniería: los principios LISTEN. Preprint en SSRN https://papers.ssrn.com/sol3/papers.cfm?abstract_id=5022896 (2024).
Agradecimientos
Los autores agradecen a S. Hopkins, F. Keesing, R. Ostfeld, A. Phelan, Z. O'Donoghue, A. Sweeny, L. Damodaran y S. Seifert por sus útiles conversaciones y ediciones durante la preparación del manuscrito. Este trabajo fue apoyado por una subvención del Instituto de Integración Biológica (DBI 2213854) de la Fundación Nacional de Ciencias (NSF) para el programa Verena (viralemergence.org). C.J.C. también contó con el apoyo de la NSF (SES 2314520).
Información del autor
Autores y Afiliaciones
Contribuciones
C.J.C., C.B.B., D.J.B., C.A.W. y T.P. investigaron los datos para el artículo. Todos los autores contribuyeron sustancialmente a la discusión del contenido, escribieron el artículo y editaron el manuscrito antes de su presentación.
Autor para correspondencia
Declaraciones éticas
Intereses contrapuestos
C.J.C. ha recibido anteriormente apoyo financiero de la Coalición para las Innovaciones en Preparación para Epidemias; ha sido consultor del Departamento de Estado de los Estados Unidos en temas de Salud Global; y recibe fondos de la Corporación Carnegie de Nueva York y la Fundación Nacional de Ciencias de EE. UU. para investigaciones relacionadas con el Acuerdo sobre la Pandemia. D.J.B. es miembro de la Comisión de Prevención del Contagio Viral de The Lancet-PPATS. Los autores declaran no tener otros intereses contrapuestos.
Revisión por pares
Información de revisión por pares
Nature Reviews Biodiversity agradece a los revisores anónimos por su contribución a la revisión por pares de este trabajo.
Información adicional
Nota del editor Springer Nature se mantiene neutral con respecto a las reclamaciones jurisdiccionales en los mapas publicados y las afiliaciones institucionales.
Enlaces relacionados
Panel de expertos de alto nivel de One Health: https://www.who.int/groups/one-health-high-level-expert-panel
Plan de Acción Conjunto «Una Salud» (2022-2026): https://www.who.int/publications/i/item/9789240059139
La base de datos del Observatorio Armonizado de Patógenos (PHAROS): www.pharos.viralemergence.org
Verena: www.viralemergence.org
Información complementaria
Glosario
- Arbovirus
Abreviatura de virus transmitido por artrópodos (como el transmitido por mosquitos o garrapatas).
- Enfermedades infecciosas emergentes
Una enfermedad infecciosa que ha experimentado recientemente una expansión del rango de huéspedes, el rango geográfico, el impacto o incluso la atención de la investigación científica o la salud pública; Este término es subjetivo, y con frecuencia se utiliza indistintamente con los términos enfermedades zoonóticas, transmitidas por vectores y transmitidas por el medio ambiente.
- Epidemia
Un brote de enfermedad infecciosa en humanos, con una duración, tamaño o impacto significativos.
- Epizootia
Brote de una enfermedad infecciosa en animales no humanos, con una duración, tamaño o impacto significativos.
- Competencia del anfitrión
La capacidad de un huésped para amplificar y transmitir la infección a otro huésped o vector susceptible.
- Macroparásito
Parásitos que se pueden observar a simple vista, como garrapatas, pulgas y algunos gusanos; El término a veces se usa indistintamente con el término parásitos.
- Microparásito
Parásitos microscópicos como bacterias, virus y algunos gusanos (por ejemplo, esquistosomas); El término a veces se usa indistintamente con el término patógenos.
- Una sola salud
Un principio que enfatiza las conexiones entre la salud humana, la salud animal y el medio ambiente, así como la importancia de soluciones que beneficien a los tres.
- Pandemia
Un brote global de alto impacto de una enfermedad infecciosa humana. Este término es subjetivo; algunas fuentes utilizan el término para describir cualquier brote mundial, y otras limitan su definición en función del grado de circulación o mortalidad (véase la Nota complementaria 3 para conocer todos los criterios que utilizamos).
- Panzoótica
Un brote mundial de alto impacto de una enfermedad infecciosa de los animales.
- Parásito
Un organismo que existe en una relación simbiótica adversa con un huésped.
- Parasitoide
Un organismo que debe matar a un huésped para completar su ciclo de vida (por ejemplo, las avispas bracónidas).
- Patógeno
Microorganismo infeccioso que causa enfermedad en un huésped.
- Embalse
Huéspedes competentes que mantienen la transmisión de patógenos a nivel poblacional o comunitario.
- Spillback (Derrame)
Transmisión de patógenos de humano a animal (también llamada zoonosis inversa).
- Derrame
Transmisión de patógenos de animal a humano.
- Sinantrópico
Vivir junto a los seres humanos (por ejemplo, en ciudades o estructuras construidas por el hombre).
- Enfermedades transmitidas por vectores
Enfermedad causada por un patógeno transmitido por un artrópodo vector, como un mosquito, una garrapata o una pulga.
- Enfermedad zoonótica
Enfermedad infecciosa humana causada por un patógeno de origen animal.
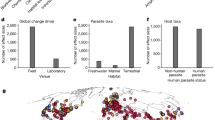
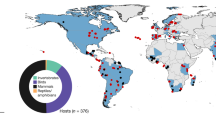
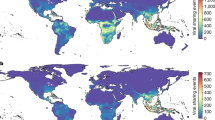
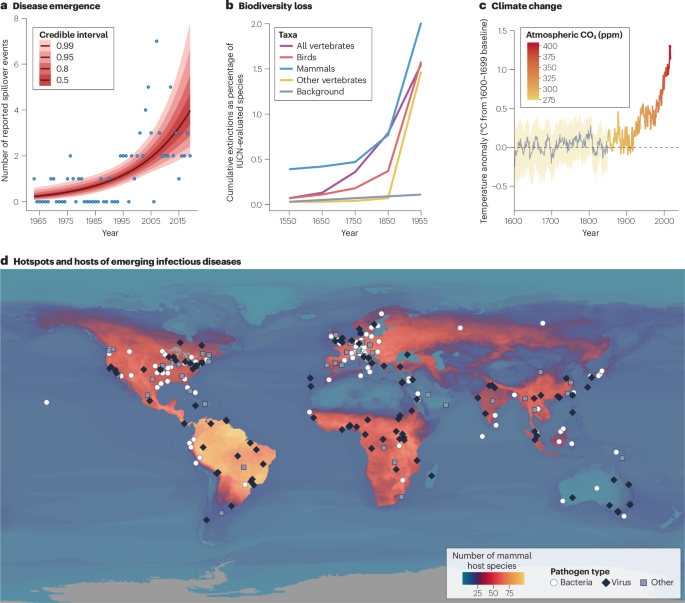
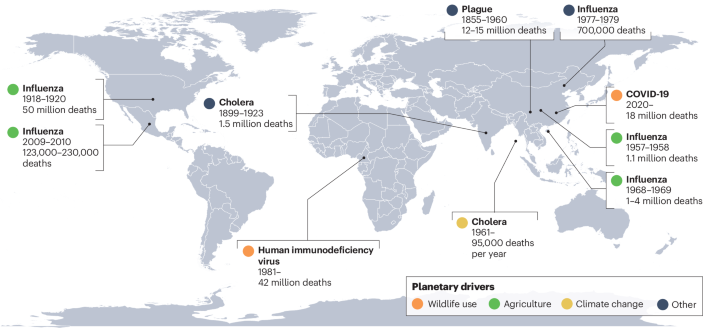
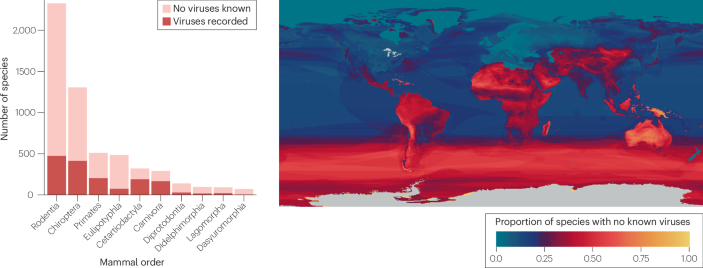
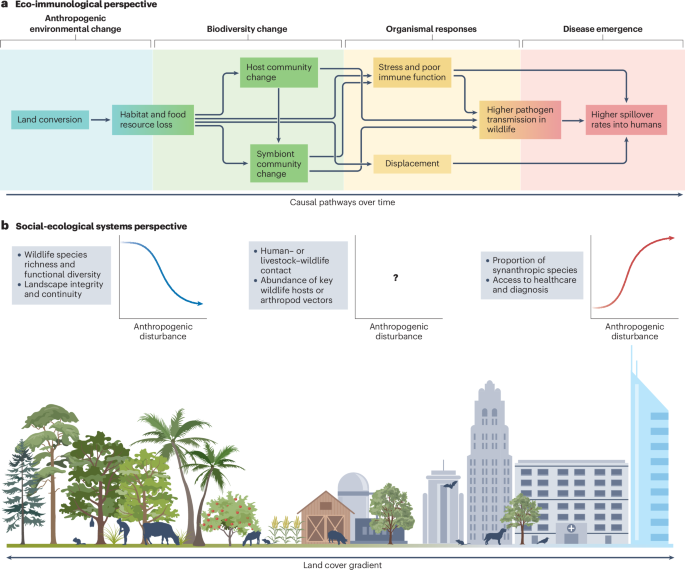
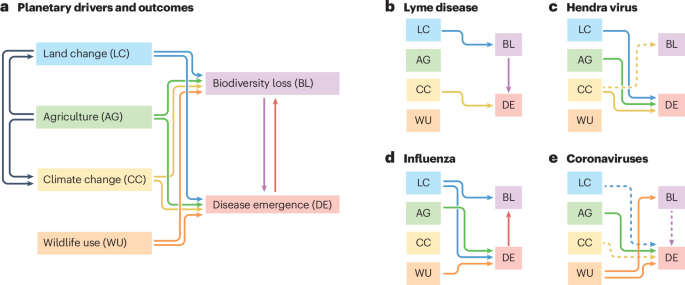
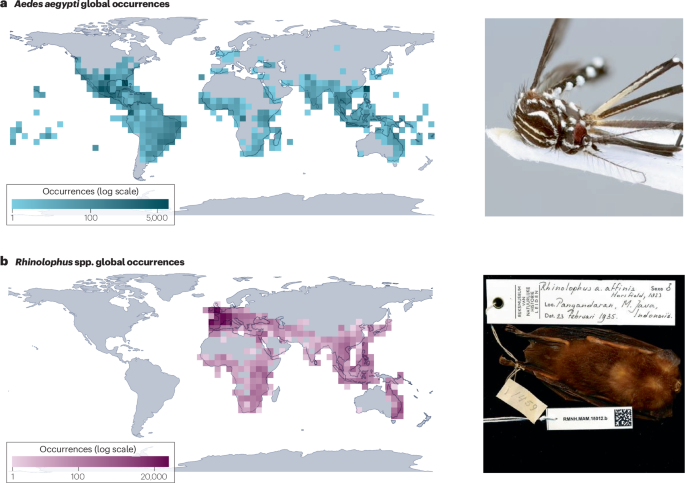
Comentarios
Publicar un comentario